Painelakien väärinymmärrykset aiheuttavat vuosittain yli $25 miljardin euron suuruiset teollisuusvikaantumiset, jotka johtuvat virheellisistä lämpölaskelmista ja turvajärjestelmien suunnittelusta. Insinöörit sekoittavat usein painelakeja muihin kaasulakeihin, mikä johtaa katastrofaalisiin laitevikoihin ja energian tehottomuuteen. Painelakien ymmärtäminen ehkäisee kalliita virheitä ja mahdollistaa optimaalisen lämpöjärjestelmien suunnittelun.
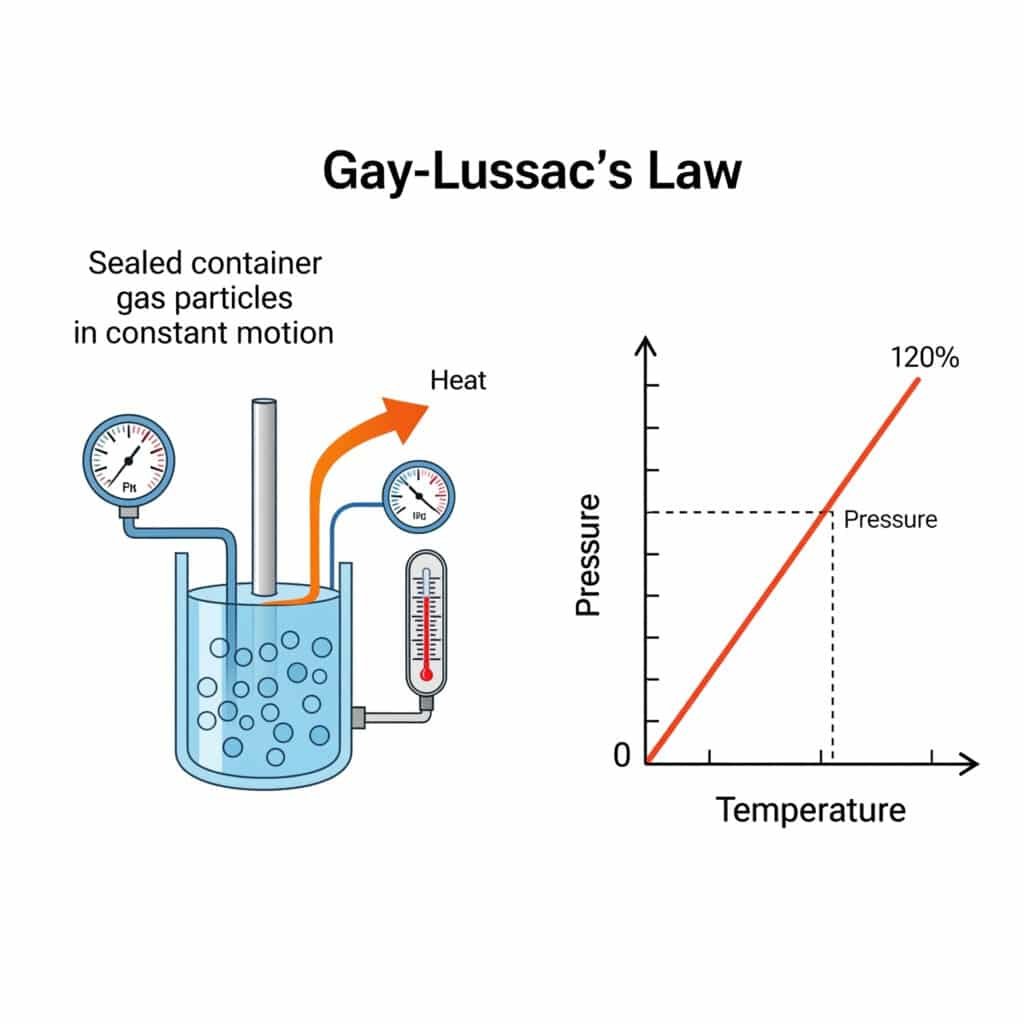
Fysiikan painelaki on Gay-Lussacin laki1, jossa todetaan, että kaasun paine on suoraan verrannollinen sen absoluuttinen lämpötila2 kun tilavuus ja määrä pysyvät vakioina, matemaattisesti ilmaistuna P₁/T₁ = P₂/T₂, joka ohjaa lämpöpainevaikutuksia teollisuusjärjestelmissä.
Kolme kuukautta sitten konsultoin ranskalaista Marie Dubois -nimistä kemianinsinööriä, jonka paineastiajärjestelmässä esiintyi vaarallisia painepiikkejä lämmitysjaksojen aikana. Hänen tiiminsä käytti yksinkertaistettuja painelaskelmia soveltamatta asianmukaisesti painelakia. Kun otimme käyttöön oikeat painelakilaskelmat ja lämpökompensoinnin, poistimme paineeseen liittyvät turvallisuustilanteet ja paransimme järjestelmän luotettavuutta 78%:llä ja vähensimme energiankulutusta 32%:llä.
Sisällysluettelo
- Mikä on Gay-Lussacin painelaki ja sen perusperiaatteet?
- Miten painelaki liittyy molekyylifysiikkaan?
- Mitkä ovat painelain matemaattiset sovellukset?
- Miten painelakia sovelletaan teollisuuden lämpöjärjestelmiin?
- Mitä turvallisuusvaikutuksia painelailla on?
- Miten painelaki liittyy muihin kaasulakeihin?
- Päätelmä
- Usein kysytyt kysymykset fysiikan painelaista
Mikä on Gay-Lussacin painelaki ja sen perusperiaatteet?
Gay-Lussacin painelaki, joka tunnetaan myös nimellä painelaki, määrittää kaasun paineen ja lämpötilan välisen perustavanlaatuisen suhteen vakiotilavuuden vallitessa ja on termodynamiikan ja kaasufysiikan kulmakivi.
Gay-Lussacin painelain mukaan kiinteän kaasumäärän paine vakiotilavuudessa on suoraan verrannollinen sen absoluuttiseen lämpötilaan, matemaattisesti ilmaistuna P₁/T₁ = P₂/T₂, mikä mahdollistaa paineen muutosten ennustamisen lämpötilan vaihteluiden myötä.
Historiallinen kehitys ja löytäminen
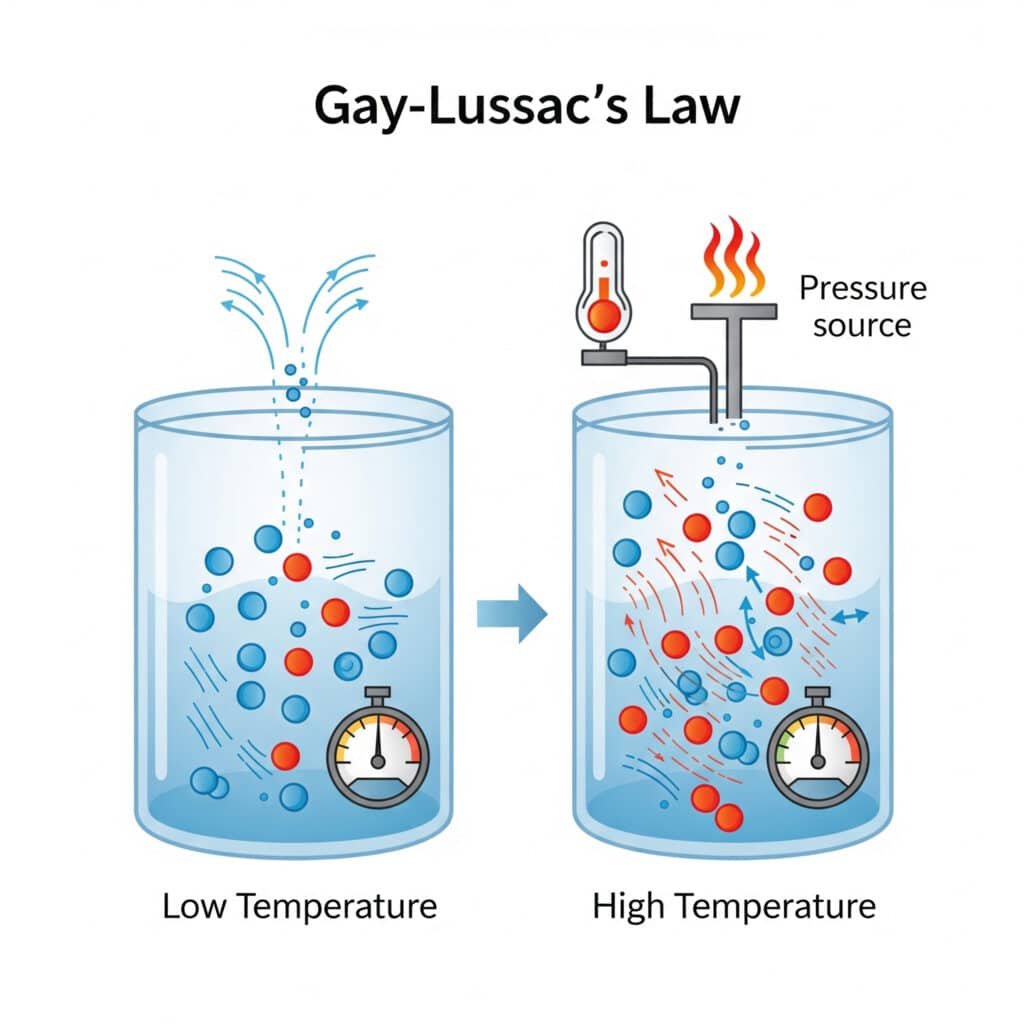
Ranskalainen kemisti Joseph Louis Gay-Lussac löysi Gay-Lussacin painelain vuonna 1802, joka perustuu Jacques Charlesin aiempaan työhön ja tarjoaa ratkaisevan tärkeää tietoa kaasujen käyttäytymisestä.
Historiallinen aikajana:
| Vuosi | Tutkija | Osallistuminen |
|---|---|---|
| 1787 | Jacques Charles | Alkuperäiset lämpötila-tilavuushavainnot |
| 1802 | Gay-Lussac | Muotoiltu paine-lämpötilalaki |
| 1834 | Émile Clapeyron | Kaasulakien yhdistäminen ideaalikaasun yhtälöksi |
| 1857 | Rudolf Clausius | Kineettinen teoria3 selitys |
Tieteellinen merkitys:
- Määrällinen suhde: Ensimmäinen tarkka matemaattinen kuvaus paine- ja lämpötilakäyttäytymisestä.
- Absoluuttinen lämpötila: Absoluuttisen lämpötila-asteikon tärkeyden osoittaminen
- Universaali käyttäytyminen: Sovelletaan kaikkiin kaasuihin ihanteellisissa olosuhteissa
- Termodynaaminen perusta: Osallistui termodynamiikan kehittämiseen
Paineen lakia koskeva peruslausuma
Painelaki määrittää paineen ja absoluuttisen lämpötilan suoran verrannollisen suhteen tietyissä olosuhteissa.
Virallinen lausunto:
"Kiinteän kaasumäärän paine vakiotilavuudessa on suoraan verrannollinen sen absoluuttiseen lämpötilaan."
Matemaattinen ilmaisu:
P ∝ T (vakiotilavuudella ja -määrällä)
P₁/T₁ = P₂/T₂. (vertailumuoto)
P = kT (jossa k on vakio)
Vaaditut edellytykset:
- Jatkuva tilavuus: Säiliön tilavuus pysyy ennallaan
- Vakiomäärä: Kaasumolekyylien määrä pysyy kiinteänä
- Ideaalikaasun käyttäytyminen: Oletetaan ideaalikaasun olosuhteet
- Absoluuttinen lämpötila: Lämpötila mitattuna Kelvinissä tai Rankinin asteikolla.
Fyysinen tulkinta
Paineen laki kuvastaa molekyylien perustavanlaatuista käyttäytymistä, jossa lämpötilan muutokset vaikuttavat suoraan molekyylien liikkeeseen ja törmäysten voimakkuuteen.
Molekulaarinen selitys:
- Korkeampi lämpötila: Lisääntynyt molekyylien kineettinen energia
- Nopeampi molekyylien liike: Suuremmalla nopeudella tapahtuvat törmäykset säiliön seinämiin.
- Lisääntynyt törmäysvoima: Voimakkaammat molekyylivaikutukset
- Korkeampi paine: Suurempi voima pinta-alayksikköä kohti säiliön seinämiin
Suhteellisuusvakio:
k = P/T = nR/V
Missä:
- n = moolien lukumäärä
- R = yleinen kaasuvakio
- V = tilavuus
Käytännön vaikutukset
Painelailla on merkittäviä käytännön vaikutuksia teollisiin järjestelmiin, joissa lämpötilan muutokset tapahtuvat suljetuissa kaasuissa.
Tärkeimmät sovellukset:
- Paineastioiden suunnittelu: Lämpöpaineen nousun huomioon ottaminen
- Turvallisuusjärjestelmän suunnittelu: Estää kuumennuksen aiheuttaman ylipaineen
- Prosessin valvonta: Paineen muutosten ennustaminen lämpötilan mukaan
- Energialaskelmat: Määritä lämpöenergian vaikutukset
Suunnittelua koskevat näkökohdat:
| Lämpötilan muutos | Paineen vaikutus | Turvallisuusvaikutukset |
|---|---|---|
| +100°C (373K - 473K) | +27% paineen nousu | Vaatii paineenalennuksen |
| +200°C (373K-573K) | +54% paineen nousu | Kriittinen turvallisuusongelma |
| -50°C (373K-323K) | -13% paineen lasku | Mahdollinen tyhjiön muodostuminen |
| -100°C (373K - 273K) | -27% paineen lasku | Rakenteelliset näkökohdat |
Miten painelaki liittyy molekyylifysiikkaan?
Paineen laki perustuu molekyylifysiikan periaatteisiin, joissa lämpötilan aiheuttamat muutokset molekyylien liikkeessä vaikuttavat suoraan paineen syntymiseen muuttuneen törmäysdynamiikan kautta.
Paineen laki heijastaa molekyylikineettistä teoriaa, jossa lämpötilan nousu nostaa molekyylien keskinopeutta, mikä johtaa tiheämpiin ja voimakkaampiin seinämätaisteluihin, jotka synnyttävät suuremman paineen P = (1/3)nmv̄² mukaisesti, mikä yhdistää mikroskooppisen liikkeen makroskooppiseen paineeseen.
Kineettisen teorian perusta
Molekyylikineettinen teoria antaa mikroskooppisen selityksen painelakiin lämpötilan ja molekyylien liikkeen välisen suhteen avulla.
Kineettisen energian ja lämpötilan suhde:
Keskimääräinen liike-energia = (3/2)kT
Missä:
- k = Boltzmannin vakio (1,38 × 10-²³ J/K).
- T = Absoluuttinen lämpötila
Molekyylinopeuden ja lämpötilan suhde:
v_rms = √(3kT/m) = √(3RT/M)
Missä:
- v_rms = nopeuden neliöllinen keskiarvo
- m = molekyylimassa
- R = kaasuvakio
- M = moolimassa
Paineen tuottamismekanismi
Paine syntyy molekyylien törmäyksistä säiliön seinämiin, ja törmäysten voimakkuus on suoraan yhteydessä molekyylien nopeuteen ja lämpötilaan.
Törmäyspohjainen paine:
P = (1/3) × n × m × v̄²
Missä:
- n = molekyylien lukumäärätiheys
- m = molekyylimassa
- v̄² = nopeuden neliön keskiarvo
Lämpötilan vaikutus paineeseen:
Koska v̄² ∝ T, P ∝ T (vakiotilavuudessa ja -määrässä).
Törmäystiheysanalyysi:
| Lämpötila | Molekyylien nopeus | Törmäystiheys | Paineen vaikutus |
|---|---|---|---|
| 273 K | 461 m/s (ilma) | 7.0 × 10⁹ s-¹ | Perustaso |
| 373 K | 540 m/s (ilma) | 8.2 × 10⁹ s-¹ | +37% paine |
| 573 K | 668 m/s (ilma) | 10.1 × 10⁹ s-¹ | +110% paine |
Maxwell-Boltzmannin jakauman vaikutukset
Lämpötilan muutokset muuttavat Maxwell-Boltzmann4 nopeusjakauma, joka vaikuttaa keskimääräiseen törmäysenergiaan ja paineen muodostumiseen.
Nopeuden jakaantumisfunktio:
f(v) = 4π(m/2πkT)^(3/2) × v² × e^(-mv²/2kT)
Lämpötilan vaikutus levitykseen:
- Korkeampi lämpötila: Laajempi levinneisyys, suurempi keskinopeus
- Alempi lämpötila: Kapeampi jakauma, alhaisempi keskinopeus.
- Jakeluvuoro: Huippunopeus kasvaa lämpötilan myötä
- Pyrstön jatke: Enemmän suurten nopeuksien molekyylejä korkeammissa lämpötiloissa.
Molekyylien törmäysdynamiikka
Paineen laki heijastaa molekyylien törmäysdynamiikan muutoksia lämpötilan vaihtelun myötä, mikä vaikuttaa sekä törmäystiheyteen että -intensiteettiin.
Törmäysparametrit:
Törmäysnopeus = (n × v̄)/4 (pinta-alayksikköä kohti sekunnissa)
Keskimääräinen törmäysvoima = m × Δv
Paine = törmäysnopeus × keskimääräinen voima
Lämpötilan vaikutus:
- Törmäystiheys: Kasvaa √T:n myötä
- Törmäyksen intensiteetti: Kasvaa T:n myötä
- Yhdistetty vaikutus: Paine kasvaa lineaarisesti T
- Seinäjännitys: Korkeampi lämpötila aiheuttaa suuremman seinämäjännityksen
Työskentelin hiljattain japanilaisen insinöörin Hiroshi Tanakan kanssa, jonka korkean lämpötilan reaktorijärjestelmässä ilmeni odottamatonta painekäyttäytymistä. Soveltamalla molekyylifysiikan periaatteita paineen lain ymmärtämiseksi korkeissa lämpötiloissa parannimme paineen ennustetarkkuutta 89%:llä ja poistimme lämpöön liittyvät laiteviat.
Mitkä ovat painelain matemaattiset sovellukset?
Painelaki tarjoaa keskeiset matemaattiset suhteet paineen muutosten laskemiseksi lämpötilan mukaan, mikä mahdollistaa tarkan järjestelmäsuunnittelun ja toimintaennusteiden tekemisen.
Paineen lain matemaattisiin sovelluksiin kuuluvat suorat suhteellisuuslaskelmat P₁/T₁ = P₂/T₂, paineen ennustekaavat, lämpölaajenemiskorjaukset ja integrointi termodynaamisiin yhtälöihin kattavaa systeemianalyysia varten.
Paineen peruslain laskelmat
Matemaattinen perussuhde mahdollistaa suoran laskennan paineen muutoksista lämpötilan vaihteluiden myötä.
Ensisijainen yhtälö:
P₁/T₁ = P₂/T₂.
Uudelleen järjestetyt muodot:
- P₂ = P₁ × (T₂/T₁). (laske loppupaine)
- T₂ = T₁ × (P₂/P₁). (laske loppulämpötila)
- P₁ = P₂ × (T₁/T₂). (laske alkupaine)
Esimerkkilaskelma:
Alkuperäiset olosuhteet: P₁ = 100 PSI, T₁ = 293 K (20°C).
Lopullinen lämpötila: T₂ = 373 K (100°C)
Lopullinen paine: P₂ = 100 × (373/293) = 127,3 PSI.
Painekertoimen laskelmat
Painekerroin ilmaisee paineen muutosnopeuden lämpötilan mukaan, mikä on olennaista lämpöjärjestelmän suunnittelussa.
Painekerroin Määritelmä:
β = (1/P) × (∂P/∂T)_V = 1/T
Ideaalikaasuille: β = 1/T (vakiotilavuudessa).
Painekertoimen sovellukset:
| Lämpötila (K) | Painekerroin (K-¹) | Paineen muutos per °C |
|---|---|---|
| 273 | 0.00366 | 0,366% per °C |
| 293 | 0.00341 | 0,341% per °C |
| 373 | 0.00268 | 0,268% per °C |
| 573 | 0.00175 | 0,175% per °C |
Lämpölaajenemispaineen laskelmat
Kun kaasuja lämmitetään suljetuissa tiloissa, painelaki laskee syntyvän paineen nousun turvallisuus- ja suunnittelutarkoituksiin.
Rajoitettu kaasulämmitys:
ΔP = P₁ × (ΔT/T₁)
jossa ΔT on lämpötilan muutos.
Turvallisuuskertoimen laskelmat:
Suunnittelupaine = käyttöpaine × (T_max/T_käyttö) × varmuuskerroin.
Esimerkki turvallisuuslaskelmasta:
Käyttöolosuhteet: 20 °C:ssa (293 K) 100 PSI
Enimmäislämpötila: 150°C (423 K)
Turvallisuuskerroin: 1,5
Suunnittelupaine: 100 × (423/293) × 1,5 = 216,5 PSI.
Graafiset esitykset
Paineen laki luo lineaarisia suhteita, kun ne piirretään oikein, mikä mahdollistaa graafisen analyysin ja ekstrapoloinnin.
Lineaarinen suhde:
P vs. T (absoluuttinen lämpötila): Suora origon kautta
Kaltevuus = P/T = vakio
Graafiset sovellukset:
- Trendianalyysi: Tunnista poikkeamat ihanteellisesta käyttäytymisestä
- Ekstrapolointi: Ennustaa käyttäytymistä ääriolosuhteissa
- Tietojen validointi: Kokeellisten tulosten tarkistaminen
- Järjestelmän optimointi: Optimaalisten toimintaolosuhteiden tunnistaminen
Integrointi termodynaamisten yhtälöiden avulla
Painelaki integroituu muiden termodynaamisten suhteiden kanssa kattavaa systeemianalyysiä varten.
Yhdistettynä ideaalikaasulakiin:
PV = nRT yhdistettynä P ∝ T antaa täydellisen kuvauksen kaasun käyttäytymisestä
Termodynaamisen työn laskelmat:
Työ = ∫P dV (äänenvoimakkuuden muutoksia varten)
Työ = nR ∫T dV/V (painelain sisällyttäminen)
Lämmönsiirtosuhteet:
Q = nCᵥΔT (vakiotilavuuslämmitys)
ΔP = (nR/V) × ΔT (paineen nousu kuumentamisesta)
Miten painelakia sovelletaan teollisuuden lämpöjärjestelmiin?
Painelakia sovelletaan kriittisiin teollisuussovelluksiin, joihin liittyy lämpötilan muutoksia suljetuissa kaasujärjestelmissä, paineastioista lämpökäsittelylaitteisiin.
Painelain teollisia sovelluksia ovat muun muassa paineastioiden suunnittelu, lämpöturvallisuusjärjestelmät, prosessilämmityslaskelmat ja pneumaattisten järjestelmien lämpötilakompensointi, jossa P₁/T₁ = P₂/T₂ määrittää paineen vasteen lämpömuutoksiin.
Paineastioiden suunnittelusovellukset
Painelaki on olennainen tekijä paineastioiden suunnittelussa, sillä se takaa turvallisen toiminnan vaihtelevissa lämpötilaolosuhteissa.
Suunnittelupaineen laskelmat:
Suunnittelupaine = Suurin käyttöpaine × (T_max/T_käytössä).
Lämpöjännitysanalyysi:
Kun kaasua kuumennetaan jäykässä astiassa:
- Paineen nousu: P₂ = P₁ × (T₂/T₁)
- Seinäjännitys: σ = P × r/t (ohutseinäinen approksimaatio)
- Turvamarginaali: Ota huomioon lämpölaajenemisvaikutukset
Suunnitteluesimerkki:
Varastointiastia: 1000 l 100 PSI:n paineessa, 20 °C:ssa.
Suurin käyttölämpötila: 80°C
Lämpötilan suhde: (80+273,15)/(20+273,15) = 353,15/293,15 = 1,205.
Suunnittelupaine: 100 × 1,205 × 1,5 (varmuuskerroin) = 180,7 PSI.
Lämpökäsittelyjärjestelmät
Teolliset lämpökäsittelyjärjestelmät tukeutuvat painelakiin paineen muutosten hallitsemiseksi ja ennustamiseksi lämmitys- ja jäähdytysjaksojen aikana.
Prosessi Sovellukset:
| Prosessin tyyppi | Lämpötila-alue | Paineen lain soveltaminen |
|---|---|---|
| Lämpökäsittely | 200-1000°C | Uunin ilmakehän paineen säätö |
| Kemialliset reaktorit | 100-500°C | Reaktiopaineen hallinta |
| Kuivausjärjestelmät | 50-200°C | Höyrynpaineen laskelmat |
| Sterilointi | 120-150°C | Höyryn painesuhteet |
Prosessinvalvontalaskelmat:
Paineen asetusarvo = peruspaine × (prosessilämpötila/peruslämpötila).
Pneumaattisen järjestelmän lämpötilan kompensointi
Pneumaattiset järjestelmät vaativat lämpötilakompensointia, jotta niiden suorituskyky säilyisi tasaisena vaihtelevissa ympäristöolosuhteissa.
Lämpötilan kompensointikaava:
P_kompensoitu = P_standardi × (T_todellinen/T_standardi).
Korvaushakemukset:
- Toimilaitteen voima: Ylläpitää johdonmukaista voimantuottoa
- Virtauksen säätö: Tiheyden muutosten kompensointi
- Paineen säätö: Säädä lämpötilan asetusarvoja
- Järjestelmän kalibrointi: Lämpövaikutusten huomioon ottaminen
Esimerkkikorvaus:
Vakioehdot: 20 °C:ssa (293,15 K) 100 PSI:tä
Käyttölämpötila: 50°C (323,15 K)
Kompensoitu paine: 100 × (323,15/293,15) = 110,2 PSI.
Turvallisuusjärjestelmän suunnittelu
Painelaki on kriittinen tekijä suunniteltaessa turvajärjestelmiä, jotka suojaavat lämpöylipaineolosuhteilta.
Varoventtiilin mitoitus:
Ylipaine = käyttöpaine × (T_max/T_käyttö) × varmuuskerroin.
Turvallisuusjärjestelmän osat:
- Paineenalennusventtiilit: Estää kuumennuksen aiheuttaman ylipaineen
- Lämpötilan seuranta: Radan lämpöolosuhteet
- Painekytkimet: Hälytys liiallisesta paineesta
- Lämpöeristys: Lämpötila-altistuksen valvonta
Lämmönvaihtimen sovellukset
Lämmönvaihtimet käyttävät painelakia ennustamaan ja hallitsemaan paineen muutoksia, kun kaasuja lämmitetään tai jäähdytetään.
Lämmönvaihtimen painelaskelmat:
ΔP_lämpö = P_tuloaukko × (T_lähtö - T_tuloaukko)/T_tuloaukko.
Suunnittelua koskevat näkökohdat:
- Painehäviö: Ota huomioon sekä kitka- että lämpövaikutukset
- Laajennusliitokset: Vastaa lämpölaajenemiseen
- Paine Luokitus: Suunnittelu suurimman lämpöpaineen saavuttamiseksi
- Ohjausjärjestelmät: Säilytä optimaaliset paineolosuhteet
Työskentelin hiljattain saksalaisen Klaus Weber -nimisen prosessi-insinöörin kanssa, jonka lämpökäsittelyjärjestelmässä ilmeni paineensäätöongelmia. Soveltamalla painelakia oikein ja ottamalla käyttöön lämpötilakompensoidun paineensäädön paransimme prosessin vakautta 73%:llä ja vähensimme lämpöön liittyviä laitevikoja 85%:llä.
Mitä turvallisuusvaikutuksia painelailla on?
Paineella on kriittisiä turvallisuusvaikutuksia teollisuusjärjestelmissä, joissa lämpötilan nousu voi aiheuttaa vaarallisia paineolosuhteita, jotka on ennakoitava ja hallittava.
Paine-erolain turvallisuusvaikutuksiin kuuluvat lämpöylipaineilta suojautuminen, paineenrajoitusjärjestelmän suunnittelu, lämpötilan seurantavaatimukset ja hätätilamenettelyt lämpötapahtumien varalta, joissa hallitsematon kuumeneminen voi aiheuttaa katastrofaalisen paineen nousun P₂ = P₁ × (T₂/T₁) mukaisesti.
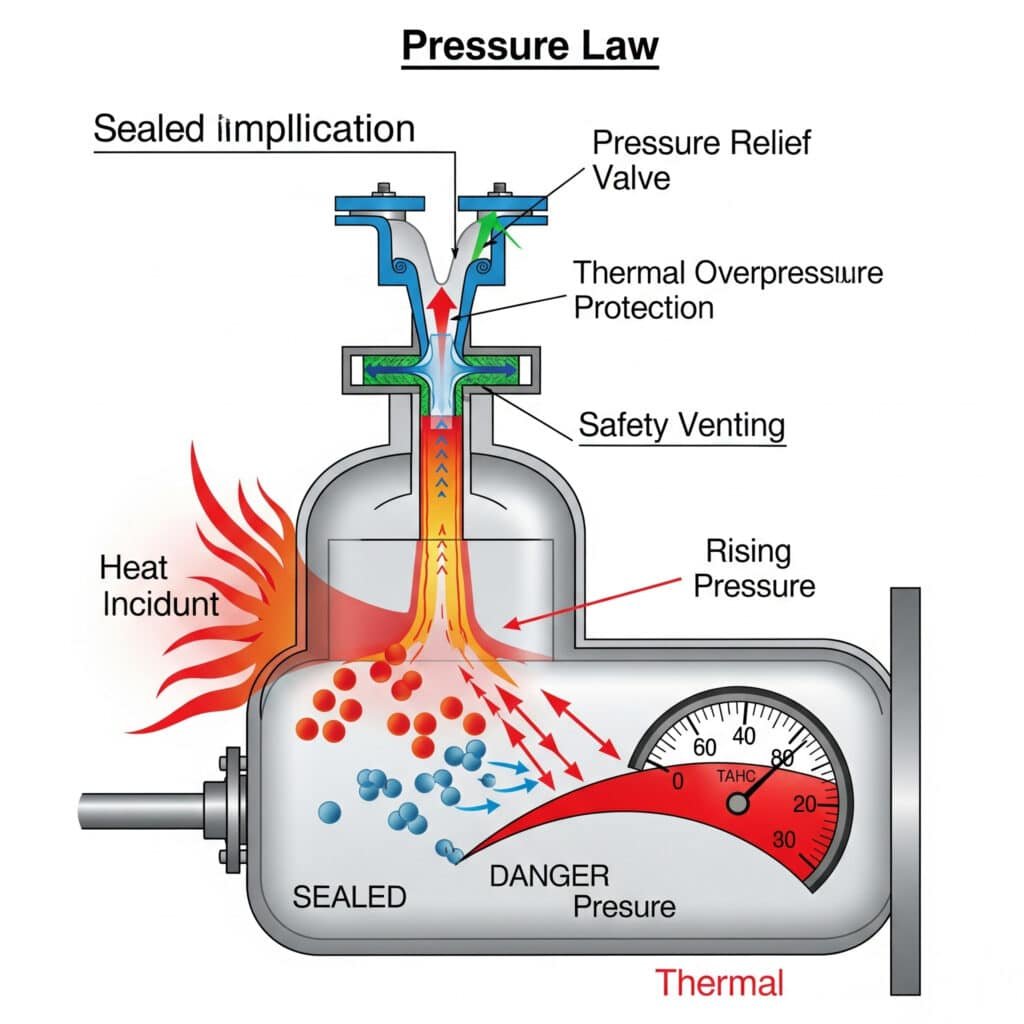
Lämpöylipaineen aiheuttamat vaarat
Hallitsematon lämpötilan nousu voi luoda vaarallisia paineolosuhteita, jotka ylittävät laitteiden suunnittelurajat ja aiheuttavat turvallisuusriskin.
Ylipaine-skenaariot:
| Skenaario | Lämpötilan nousu | Paineen nousu | Vaarataso |
|---|---|---|---|
| Tulipalolle altistuminen | +500°C (293K-793K) | +171% | Katastrofaalinen |
| Prosessin häiriö | +100°C (293K - 393K) | +34% | Vakava |
| Aurinkolämmitys | +50°C (293K-343K) | +17% | Kohtalainen |
| Laitteiden toimintahäiriö | +200°C (293K - 493K) | +68% | Kriittinen |
Vikaantumistavat:
- Aluksen repeämä: Ylipaineesta johtuva katastrofaalinen vikaantuminen
- Tiivisteen vikaantuminen: Paineen/lämpötilan aiheuttama tiivisteen ja tiivisteen vaurioituminen.
- Putkiston vikaantuminen: Lämpöjännityksen aiheuttama linjan repeäminen
- Komponentin vaurioituminen: Lämpösyklien aiheuttama laitevika
Paineenalennusjärjestelmän suunnittelu
Paineenrajoitusjärjestelmissä on otettava huomioon lämpöpaineen nousu, jotta ne tarjoavat riittävän suojan ylipaineolosuhteita vastaan.
Varoventtiilin mitoitus:
Huojennuskapasiteetti = Suurin lämpöpaine × virtauskerroin
Lämpötilalaskelmat:
P_relief = P_operating × (T_max/T_operating) × 1,1 (10%-marginaali)
Järjestelmän komponentit:
- Ensisijainen helpotus: Pääpaineen varoventtiili
- Toissijainen helpotus: Varmuuskopiointisuojausjärjestelmä
- Murtolevyjä: Perimmäinen ylipainesuojaus
- Thermal Relief: Erityinen lämpölaajenemissuoja
Lämpötilan seuranta ja valvonta
Tehokas lämpötilan valvonta estää vaaralliset paineen nousut havaitsemalla lämpöolosuhteet ennen kuin niistä tulee vaarallisia.
Seurantavaatimukset:
- Lämpötila-anturit: Jatkuva lämpötilan mittaus
- Paineanturit: Seuraa paineen nousua
- Hälytysjärjestelmät: Varoittaa käyttäjiä vaarallisista olosuhteista
- Automaattinen sammutus: Hätäjärjestelmän eristäminen
Valvontastrategiat:
| Valvontamenetelmä | Vasteaika | Tehokkuus | Sovellukset |
|---|---|---|---|
| Lämpötilahälytykset | Sekunnit | Korkea | Varhainen varoitus |
| Paineen lukitukset | Millisekuntia | Erittäin korkea | Hätäsulku |
| Jäähdytysjärjestelmät | Pöytäkirja | Kohtalainen | Lämpötilan säätö |
| Eristysventtiilit | Sekunnit | Korkea | Järjestelmän eristäminen |
Hätätilannemenettelyt
Hätätilannemenettelyissä on otettava huomioon painelain vaikutukset lämpötapahtumien aikana, jotta voidaan varmistaa turvallinen toiminta ja järjestelmän sammuttaminen.
Hätäskenaariot:
- Tulipalolle altistuminen: Nopea lämpötilan ja paineen nousu
- Jäähdytysjärjestelmän vika: Asteittainen lämpötilan nousu
- Runaway Reaction: Nopea lämpö- ja paineenmuodostus
- Ulkoinen lämmitys: Auringon tai säteilylämmön altistuminen
Vastausmenettelyt:
- Välitön eristäminen: Pysäytä lämmöntuottolähteet
- Paineenalennus: Aktivoi apujärjestelmät
- Jäähdytyksen aloittaminen: Käytä hätäjäähdytystä
- Järjestelmän paineenalennus: Vähennä painetta turvallisesti
- Alueen evakuointi: Suojaa henkilöstöä
Lainsäädännön noudattaminen
Turvallisuusmääräykset edellyttävät lämpöpainevaikutusten huomioon ottamista järjestelmän suunnittelussa ja käytössä.
Sääntelyvaatimukset:
- ASME-kattilakoodi5: Paineastian lämpösuunnittelu
- API-standardit: Prosessilaitteiden lämpösuojaus
- OSHA-säännökset: Työntekijöiden turvallisuus lämpöjärjestelmissä
- Ympäristösäännökset: Turvallinen lämpöpurkaus
Noudattamisstrategiat:
- Suunnittelustandardit: Noudata tunnustettuja lämpösuunnittelukoodeja
- Turvallisuusanalyysi: Suorita lämpövaaran analyysi
- Dokumentaatio: Ylläpidä lämpöturvallisuustietoja
- Koulutus: Koulutetaan henkilöstöä lämpövaaroista
Riskien arviointi ja hallinta
Kattavassa riskinarvioinnissa on otettava huomioon lämpöpaineen vaikutukset mahdollisten vaarojen tunnistamiseksi ja lieventämiseksi.
Riskinarviointiprosessi:
- Vaarojen tunnistaminen: Tunnista lämpöpaineen lähteet
- Seurausten analysointi: Arvioi mahdolliset tulokset
- Todennäköisyysarviointi: Määritä esiintymistodennäköisyys
- Riskiluokitus: Riskien priorisointi lieventämistä varten
- Lieventämisstrategiat: Suojatoimenpiteiden toteuttaminen
Riskien lieventämistoimenpiteet:
- Suunnittelumarginaalit: Ylisuuret laitteet lämpövaikutuksia varten
- Redundantti suojaus: Useita turvajärjestelmiä
- Ennaltaehkäisevä huolto: Järjestelmän säännöllinen tarkastus
- Operaattorin koulutus: Lämpöturvallisuustietoisuus
- Hätäsuunnittelu: Lämpötapahtumiin reagoimista koskevat menettelyt
Miten painelaki liittyy muihin kaasulakeihin?
Painelaki integroituu muiden kaasujen peruslakien kanssa, jolloin muodostuu kattava käsitys kaasujen käyttäytymisestä ja luodaan perusta kehittyneelle termodynaamiselle analyysille.
Paineen laki integroituu Boylen lakiin (P₁V₁ = P₂V₂), Charlesin lakiin (V₁/T₁ = V₂/T₂) ja Avogadron lakiin muodostaen yhdistetyn kaasulain ja ideaalikaasun yhtälön PV = nRT, joka antaa täydellisen kuvauksen kaasun käyttäytymisestä.
Yhdistetyn kaasulain integrointi
Paineen laki yhdistyy muihin kaasulakeihin ja muodostaa kattavan yhdistetyn kaasulain, joka kuvaa kaasun käyttäytymistä, kun useat ominaisuudet muuttuvat samanaikaisesti.
Yhdistetty kaasulaki:
(P₁V₁)/T₁ = (P₂V₂)/T₂.
Tämä yhtälö sisältää:
- Paineen laki: P₁/T₁ = P₂/T₂ (vakiotilavuus).
- Boylen laki: P₁V₁ = P₂V₂ (vakiolämpötila).
- Charlesin laki: V₁/T₁ = V₂/T₂ (vakiopaine).
Yksilöllinen lain johdannainen:
Yhdistetyn kaasun laista:
- Aseta V₁ = V₂ → P₁/T₁ = P₂/T₂ (painelaki).
- Asetetaan T₁ = T₂ → P₁V₁ = P₂V₂ (Boylen laki).
- Aseta P₁ = P₂ → V₁/T₁ = V₂/T₂ (Charlesin laki).
Ideaalikaasun lain kehitys
Paineen laki on osa ideaalikaasulakia, joka on kattavin kuvaus kaasun käyttäytymisestä.
Ideaalikaasun laki:
PV = nRT
Johdanto kaasulakeihin:
- Boylen laki: P ∝ 1/V (vakio T, n)
- Charlesin laki: V ∝ T (vakio P, n)
- Paineen laki: P ∝ T (vakio V, n)
- Avogadron laki: V ∝ n (vakio P, T)
Yhdistetty: PV ∝ nT → PV = nRT
Termodynaamisten prosessien integrointi
Painelaki integroituu termodynaamisiin prosesseihin ja kuvaa kaasun käyttäytymistä eri olosuhteissa.
Prosessityypit:
| Prosessi | Kiinteä ominaisuus | Paineen lain soveltaminen |
|---|---|---|
| Isokorinen | Volume | Suora soveltaminen: P ∝ T |
| Isobaarinen | Paine | Yhdistettynä Charlesin lakiin |
| Isoterminen | Lämpötila | Ei suoraa soveltamista |
| Adiabaattinen | Ei lämmönsiirtoa | Muutetut suhteet |
Isokorinen prosessi (vakiotilavuus):
P₁/T₁ = P₂/T₂. (suoran painelain soveltaminen)
Työ = 0 (ei äänenvoimakkuuden muutosta)
Q = nCᵥΔT (lämpö on yhtä kuin sisäisen energian muutos)
Reaalikaasukäyttäytymisen integrointi
Paineen laki ulottuu todellisen kaasun käyttäytymiseen tilayhtälöiden avulla, joissa otetaan huomioon molekyylien vuorovaikutukset ja rajallinen molekyylikoko.
Van der Waalsin yhtälö:
(P + a/V²)(V - b) = RT
Missä:
- a = molekyylien välisen vetovoiman korjaus
- b = molekyylitilavuuden korjaus
Todellinen kaasunpaineen laki:
P_real = RT/(V-b) - a/V²
Paineen laki pätee edelleen, mutta siihen on tehty korjauksia todellisen kaasun käyttäytymisen huomioon ottamiseksi.
Kineettisen teorian integrointi
Painelaki integroituu kineettiseen molekyyliteoriaan, jotta kaasun makroskooppinen käyttäytyminen voidaan ymmärtää mikroskooppisesti.
Kineettisen teorian suhteet:
P = (1/3)nmv̄² (mikroskooppinen paine)
v̄² ∝ T (nopeuden ja lämpötilan suhde)
Siksi: P ∝ T (kineettisen teorian painelaki)
Integroinnin edut:
- Mikroskooppinen ymmärrys: Makroskooppisten lakien molekulaarinen perusta
- Ennustuskyky: Käyttäytymisen ennustaminen ensimmäisistä periaatteista
- Rajoituksen tunnistaminen: Olosuhteet, joissa lait rikkoutuvat
- Edistyneet sovellukset: Monimutkaisten järjestelmien analyysi
Työskentelin hiljattain eteläkorealaisen insinöörin Park Min-junin kanssa, jonka monivaiheinen kompressiojärjestelmä vaati integroitua kaasulain analyysia. Soveltamalla asianmukaisesti painelakia yhdessä muiden kaasulakien kanssa optimoimme järjestelmän suunnittelun, jolloin saavutimme 43% energiansäästön ja samalla 67% suorituskyvyn parannuksen.
Käytännön integrointisovellukset
Integroidut kaasulakisovellukset ratkaisevat monimutkaisia teollisia ongelmia, joihin liittyy useita muuttuvia muuttujia ja olosuhteita.
Monimuuttujaiset ongelmat:
- Samanaikaiset P-, V- ja T-muutokset: Käytä yhdistettyä kaasulakia
- Prosessin optimointi: Sovelletaan asianmukaisia lakikombinaatioita
- Turvallisuusanalyysi: Harkitse kaikkia mahdollisia muuttujien muutoksia
- Järjestelmän suunnittelu: Integroi useita kaasulain vaikutuksia
Tekniset sovellukset:
- Kompressorin suunnittelu: Paineen ja tilavuuden vaikutusten integrointi
- Lämmönvaihtimen analyysi: Yhdistetään lämpö- ja painevaikutukset
- Prosessin valvonta: Käytä integroituja suhteita valvontaan
- Turvallisuusjärjestelmät: Ota huomioon kaikki kaasulain mukaiset vuorovaikutukset
Päätelmä
Paineen laki (Gay-Lussacin laki) osoittaa, että kaasun paine on suoraan verrannollinen absoluuttiseen lämpötilaan vakiotilavuudessa (P₁/T₁ = P₂/T₂), mikä on olennaista lämpöjärjestelmien suunnittelussa, turvallisuusanalyyseissä ja teollisuusprosessien ohjauksessa, jossa lämpötilan muutokset vaikuttavat paineolosuhteisiin.
Usein kysytyt kysymykset fysiikan painelaista
Mikä on fysiikan painelaki?
Paineen laki, joka tunnetaan myös Gay-Lussacin lakina, sanoo, että kaasun paine on suoraan verrannollinen sen absoluuttiseen lämpötilaan, kun tilavuus ja määrä pysyvät vakiona, ja se ilmaistaan seuraavasti: P₁/T₁ = P₂/T₂ tai P ∝ T.
Miten painelaki liittyy molekyylien käyttäytymiseen?
Paineen laki heijastaa molekyylikineettistä teoriaa, jonka mukaan korkeammat lämpötilat lisäävät molekyylien nopeutta ja törmäysintensiteettiä säiliön seinämiin, mikä aiheuttaa korkeamman paineen molekyylien tiheämpien ja voimakkaampien törmäysten vuoksi.
Mitä matemaattisia sovelluksia painelailla on?
Matemaattisia sovelluksia ovat paineen muutosten laskeminen lämpötilan mukaan (P₂ = P₁ × T₂/T₁), painekertoimien määrittäminen (β = 1/T) ja lämpöjärjestelmien suunnittelu asianmukaisilla painemarginaaleilla.
Miten painelakia sovelletaan työturvallisuuteen?
Teollisuuden turvallisuussovelluksiin kuuluvat paineenrajoitusventtiilien mitoitus, lämpöylipaineensuojaus, lämpötilan seurantajärjestelmät ja hätätilamenettelyt vaarallisia paineenkorotuksia aiheuttavien lämpötapahtumien varalta.
Mitä eroa on painelailla ja muilla kaasulailla?
Paineen laki suhteuttaa paineen lämpötilaan vakiotilavuuden vallitessa, Boylen laki paineen tilavuuteen vakiolämpötilan vallitessa ja Charlesin laki tilavuuden lämpötilaan vakiopaineen vallitessa.
Miten painelaki integroituu ideaalikaasulakiin?
Painelaki yhdistyy muiden kaasulakien kanssa ideaalikaasun yhtälöksi PV = nRT, jossa paine-lämpötila-suhde (P ∝ T) on yksi osa kaasun käyttäytymisen kokonaisvaltaista kuvausta.
-
Tarjoaa yksityiskohtaisen selityksen Gay-Lussacin laista, joka on fysiikan peruskaasulaki, joka kuvaa kaasun paineen ja absoluuttisen lämpötilan välistä suoraa yhteyttä vakiotilavuudessa. ↩
-
Selitetään absoluuttisten lämpötila-asteikkojen, kuten Kelvinin, käsite, joka alkaa absoluuttisesta nollapisteestä, teoreettisesta pisteestä, jossa hiukkasten värähtelyliike on minimaalista, mikä on ratkaiseva edellytys kaasulakien laskemisessa. ↩
-
Tarjoaa yleiskatsauksen kaasujen kineettiseen teoriaan, joka on tieteellinen malli, joka selittää kaasujen makroskooppiset ominaisuudet (kuten paineen ja lämpötilan) ottamalla huomioon niiden muodostavien molekyylien liikkeet ja vuorovaikutukset. ↩
-
Kuvaa Maxwell-Boltzmannin jakaumaa, joka on tilastomekaniikan todennäköisyysjakauma, joka määrittää kaasun hiukkasten nopeusjakauman tietyssä lämpötilassa ja joka on keskeinen osa kaasujen kineettistä teoriaa. ↩
-
Tarjoaa tietoa ASME Boiler and Pressure Vessel Code (BPVC) -standardista, joka on tärkeä standardi, jolla säännellään kattiloiden ja paineastioiden suunnittelua, rakentamista ja tarkastusta turvallisuuden varmistamiseksi. Tämä standardi sisältää myös lämpöpainevaikutusten huomioon ottamisen. ↩


