Nepareizu siltuma aprēķinu un drošības sistēmu konstrukciju dēļ spiediena likumu pārpratumi ik gadu izraisa vairāk nekā $25 miljardus rūpniecisku kļūmju, kas saistītas ar nepareiziem siltuma aprēķiniem un drošības sistēmu konstrukcijām. Inženieri bieži sajauc spiediena likumus ar citiem gāzes likumiem, izraisot katastrofālas iekārtu kļūmes un energoefektivitātes trūkumu. Spiediena likumu izpratne novērš dārgi izmaksājošas kļūdas un ļauj optimāli projektēt siltuma sistēmas.
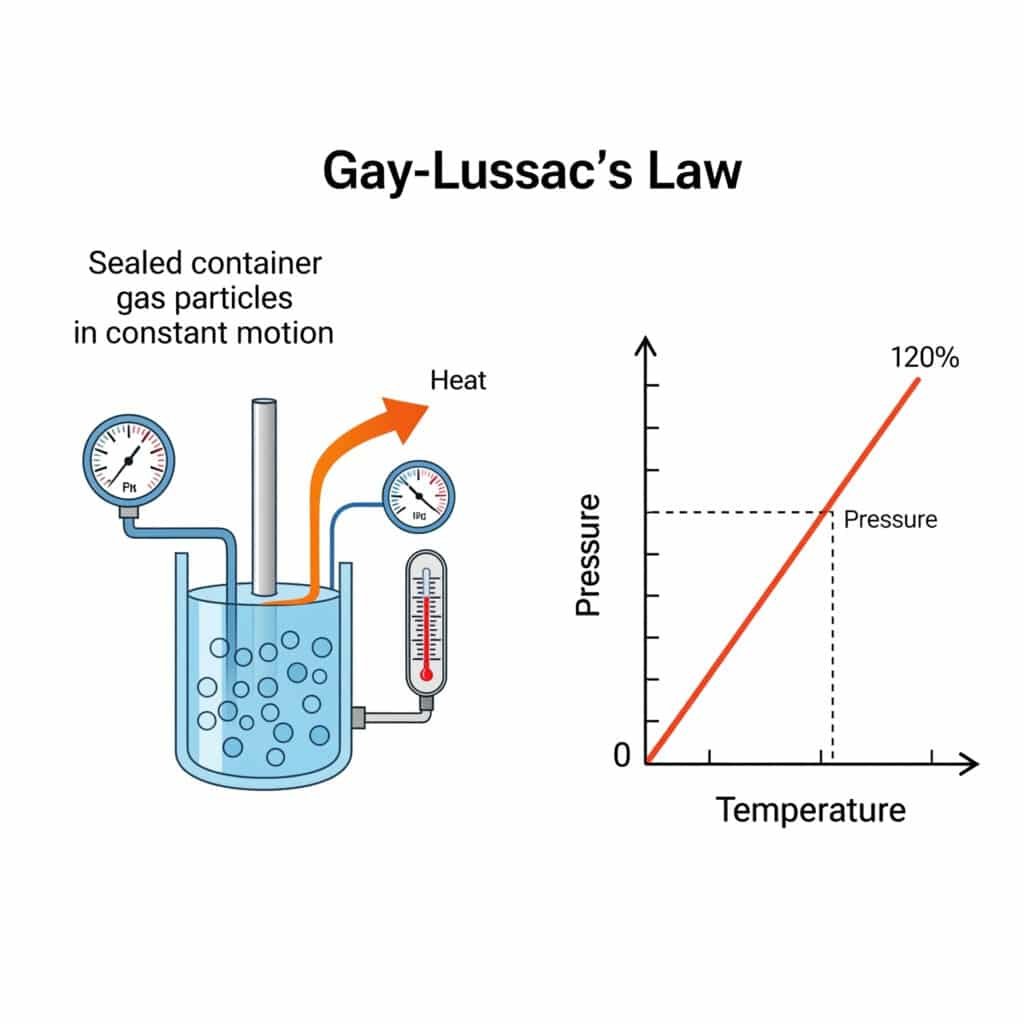
Spiediena likums fizikā ir šāds. Gejas-Lusaka likums1, kas nosaka, ka gāzes spiediens ir tieši proporcionāls tās absolūtā temperatūra2 kad tilpums un daudzums paliek nemainīgi, matemātiski izteikts kā P₁/T₁ = P₂/T₂, kas regulē termiskā spiediena iedarbību rūpnieciskās sistēmās.
Pirms trim mēnešiem es konsultēju franču ķīmijas inženieri Mariju Dubois, kuras spiediena tvertnes sistēmā sildīšanas ciklu laikā bija bīstami spiediena kāpumi. Viņas komanda izmantoja vienkāršotus spiediena aprēķinus, nepareizi piemērojot spiediena likumu. Ieviešot pareizus spiediena likuma aprēķinus un siltuma kompensāciju, mēs novērsām ar spiedienu saistītus drošības incidentus un uzlabojām sistēmas uzticamību par 78%, vienlaikus samazinot enerģijas patēriņu par 32%.
Satura rādītājs
- Kas ir Gejas-Lusaka spiediena likums un tā pamatprincipi?
- Kā spiediena likums ir saistīts ar molekulāro fiziku?
- Kādi ir spiediena likuma matemātiskie lietojumi?
- Kā spiediena likums ir piemērojams rūpnieciskajām siltuma sistēmām?
- Kāda ir spiediena likuma ietekme uz drošību?
- Kā spiediena likums integrējas ar citiem gāzes likumiem?
- Secinājums
- Biežāk uzdotie jautājumi par spiediena likumu fizikā
Kas ir Gejas-Lusaka spiediena likums un tā pamatprincipi?
Gajs-Lušaka spiediena likums, pazīstams arī kā spiediena likums, nosaka pamatsakarību starp gāzes spiedienu un temperatūru pie nemainīga tilpuma, kas ir termodinamikas un gāzes fizikas stūrakmens.
Gajs-Lušaka spiediena likums nosaka, ka nemainīga gāzes daudzuma pie nemainīga tilpuma spiediens ir tieši proporcionāls tā absolūtajai temperatūrai, kas matemātiski izteikts kā P₁/T₁ = P₂/T₂, ļaujot paredzēt spiediena izmaiņas atkarībā no temperatūras izmaiņām.
Vēsturiskā attīstība un atklājumi
Gajs-Lusaka spiediena likumu 1802. gadā atklāja franču ķīmiķis Žozefs Luijs Gajs-Lusaks, balstoties uz Žaka Šarla agrāko darbu un sniedzot būtisku ieskatu gāzu uzvedībā.
Vēsturiskā laika līnija:
| Gads | Zinātnieks | Iemaksas |
|---|---|---|
| 1787 | Žaks Čārlzs | Sākotnējie temperatūras un tilpuma novērojumi |
| 1802 | Gay-Lussac | Formulētais spiediena un temperatūras likums |
| 1834 | Emīls Klapjērs (Émile Clapeyron) | Gāzes likumu apvienošana ideālās gāzes vienādojumā |
| 1857 | Rūdolfs Klauziuss | Kinētiskā teorija3 paskaidrojums |
Zinātniskā nozīme:
- Kvantitatīvā saistība: Pirmais precīzs spiediena un temperatūras uzvedības matemātiskais apraksts
- Absolūtā temperatūra: Parādīta absolūtās temperatūras skalas nozīme
- Universālā uzvedība: Piemēro visām gāzēm ideālos apstākļos
- Termodinamiskais pamats: Sniedzis ieguldījumu termodinamikas attīstībā
Spiediena likuma pamatprincips
Spiediena likums nosaka tieši proporcionālu sakarību starp spiedienu un absolūto temperatūru konkrētos apstākļos.
Oficiāls paziņojums:
"Nemainīga gāzes daudzuma nemainīga tilpuma spiediens ir tieši proporcionāls tās absolūtajai temperatūrai."
Matemātiskā izteiksme:
P ∝ T (pie nemainīga tilpuma un daudzuma)
P₁/T₁ = P₂/T₂ (salīdzinošā forma)
P = kT (kur k ir konstante)
Nepieciešamie nosacījumi:
- Pastāvīgs tilpums: Konteinera tilpums paliek nemainīgs
- Konstanta summa: Gāzes molekulu skaits paliek nemainīgs
- Ideālās gāzes uzvedība: Pieņem ideālās gāzes apstākļus
- Absolūtā temperatūra: Temperatūra, ko mēra Kelvinā vai Rankīnā
Fiziskā interpretācija
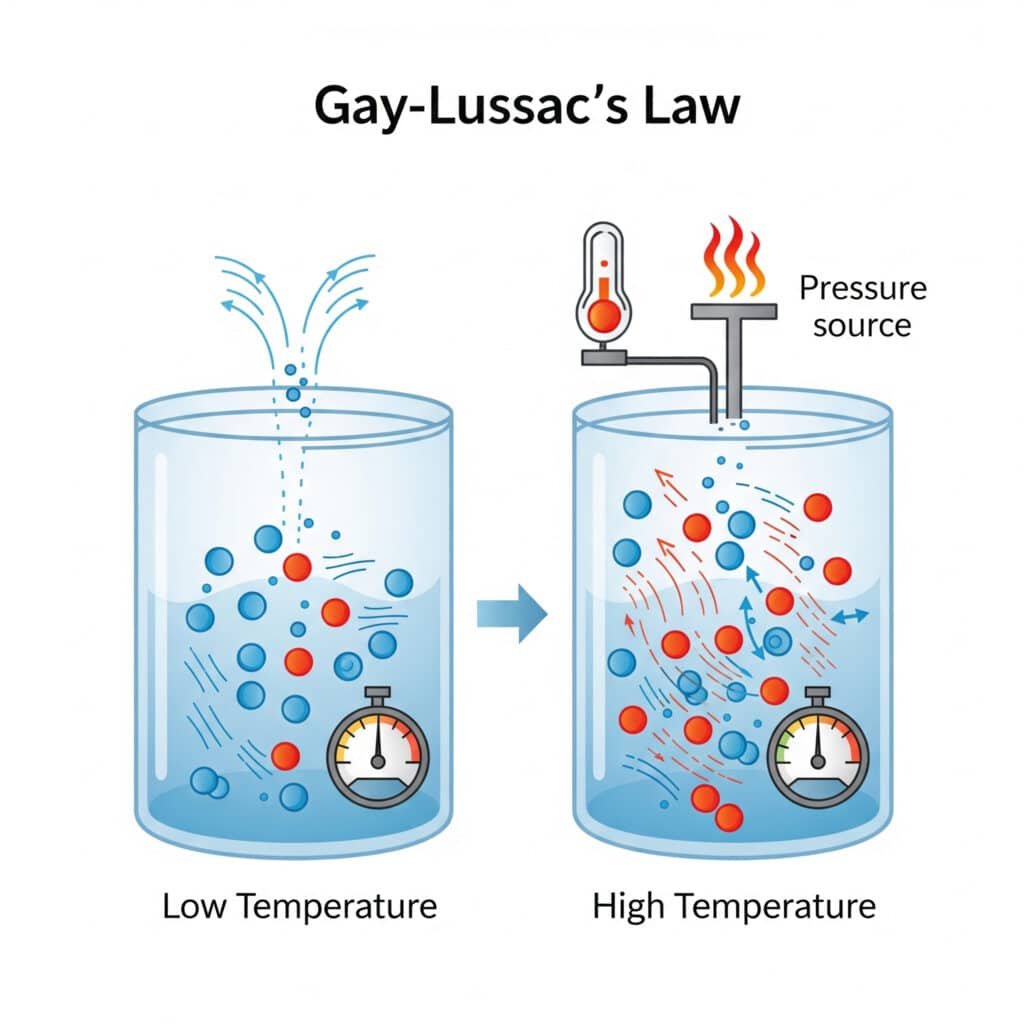
Spiediena likums atspoguļo fundamentālu molekulu uzvedību, kur temperatūras izmaiņas tieši ietekmē molekulu kustību un sadursmju intensitāti.
Molekulārais skaidrojums:
- Augstāka temperatūra: Palielināta molekulārā kinētiskā enerģija
- Ātrāka molekulu kustība: Lielāka ātruma sadursmes ar konteinera sieniņām
- Lielāks sadursmes spēks: Intensīvāka molekulārā ietekme
- Augstāks spiediens: Lielāks spēks uz konteinera sieniņu laukuma vienību
Proporcionalitātes konstante:
k = P/T = nR/V
Kur:
- n = molu skaits
- R = universālā gāzes konstante
- V = tilpums
Praktiskās sekas
Spiediena likumam ir būtiska praktiska nozīme rūpnieciskās sistēmās, kas saistītas ar temperatūras izmaiņām noslēgtās gāzēs.
Galvenie lietojumprogrammu veidi:
- Spiediena tvertnes konstrukcija: Ņemiet vērā termiskā spiediena palielināšanos
- Drošības sistēmas projektēšana: Novērst pārspiedienu no sildīšanas
- Procesa kontrole: Paredzēt spiediena izmaiņas atkarībā no temperatūras
- Enerģijas aprēķini: Noteikt siltumenerģijas ietekmi
Dizaina apsvērumi:
| Temperatūras izmaiņas | Spiediena efekts | Ietekme uz drošību |
|---|---|---|
| +100°C (373K līdz 473K) | +27% spiediena pieaugums | Nepieciešama spiediena samazināšana |
| +200°C (373K līdz 573K) | +54% spiediena palielinājums | Kritiski svarīgi drošības apsvērumi |
| -50°C (373K līdz 323K) | -13% spiediena samazinājums | Iespējamā vakuuma veidošanās |
| -100°C (373K līdz 273K) | -27% spiediena samazinājums | Strukturālie apsvērumi |
Kā spiediena likums ir saistīts ar molekulāro fiziku?
Spiediena likums izriet no molekulārās fizikas principiem, kur temperatūras izraisītas izmaiņas molekulu kustībā tieši ietekmē spiediena veidošanos, mainoties sadursmju dinamikai.
Spiediena likums atspoguļo molekulu kinētisko teoriju, kurā temperatūras paaugstināšanās palielina vidējo molekulu ātrumu, izraisot biežākas un intensīvākas sadursmes sieniņās, kas rada lielāku spiedienu saskaņā ar P = (1/3)nmv̄², kas savieno mikroskopisko kustību ar makroskopisko spiedienu.
Kinētiskās teorijas pamats
Molekulārās kinētikas teorija sniedz spiediena likuma mikroskopisku skaidrojumu, izmantojot sakarību starp temperatūru un molekulu kustību.
Kinētiskās enerģijas un temperatūras attiecība:
Vidējā kinētiskā enerģija = (3/2)kT
Kur:
- k = Bolcmaņa konstante (1,38 × 10-²³ J/K)
- T = absolūtā temperatūra
Molekulārā ātruma un temperatūras attiecība:
v_rms = √(3kT/m) = √(3RT/M)
Kur:
- v_rms = vidējais kvadrātiskais ātrums
- m = Molekulmasa
- R = Gāzes konstante
- M = molārā masa
Spiediena radīšanas mehānisms
Spiedienu rada molekulu sadursmes ar tvertnes sieniņām, un sadursmju intensitāte ir tieši saistīta ar molekulu ātrumu un temperatūru.
Uz sadursmēm balstīts spiediens:
P = (1/3) × n × m × v̄²
Kur:
- n = molekulu skaita blīvums
- m = Molekulmasa
- v̄² = vidējais kvadrātiskais ātrums
Temperatūras ietekme uz spiedienu:
Tā kā v̄² ∝ T, tad P ∝ T (pie nemainīga tilpuma un daudzuma)
Sadursmju biežuma analīze:
| Temperatūra | Molekulārais ātrums | Sadursmju biežums | Spiediena efekts |
|---|---|---|---|
| 273 K | 461 m/s (gaiss) | 7.0 × 10⁹ s-¹ | Pamatlīnija |
| 373 K | 540 m/s (gaiss) | 8.2 × 10⁹ s-¹ | +37% spiediens |
| 573 K | 668 m/s (gaiss) | 10.1 × 10⁹ s-¹ | +110% spiediens |
Maksvela-Bolcmana sadalījuma efekti
Temperatūras izmaiņas maina Maksvela-Bolcmana4 ātruma sadalījumu, kas ietekmē vidējo sadursmes enerģiju un radīto spiedienu.
Ātruma sadalījuma funkcija:
f(v) = 4π(m/2πkT)^(3/2) × v² × e^(-mv²/2kT)
Temperatūras ietekme uz izplatību:
- Augstāka temperatūra: Plašāka izplatība, lielāks vidējais ātrums
- Zemāka temperatūra: Šaurāks sadalījums, mazāks vidējais ātrums
- Izplatīšanas maiņa: Maksimālais ātrums palielinās līdz ar temperatūru
- Astes pagarinājums: Vairāk liela ātruma molekulu augstākā temperatūrā
Molekulāro sadursmju dinamika
Spiediena likums atspoguļo izmaiņas molekulu sadursmju dinamikā, mainoties temperatūrai, kas ietekmē gan sadursmju biežumu, gan intensitāti.
Sadursmes parametri:
Sadursmju ātrums = (n × v̄)/4 (uz platības vienību sekundē)
Vidējais sadursmes spēks = m × Δv
Spiediens = sadursmes ātrums × vidējais spēks
Temperatūras ietekme:
- Sadursmju biežums: Palielinās līdz ar √T
- Sadursmes intensitāte: Palielinās līdz ar T
- Kombinētais efekts: Spiediens pieaug lineāri ar T
- Sienas spriegums: Augstāka temperatūra rada lielāku sienu spriegumu
Nesen es sadarbojos ar japāņu inženieri Hiroshi Tanaku, kura augsttemperatūras reaktora sistēmai bija negaidīta spiediena uzvedība. Piemērojot molekulārās fizikas principus, lai izprastu spiediena likumu paaugstinātā temperatūrā, mēs uzlabojām spiediena prognozēšanas precizitāti par 89% un novērsām ar termiku saistītās iekārtu kļūmes.
Kādi ir spiediena likuma matemātiskie lietojumi?
Spiediena likums nodrošina būtiskas matemātiskas sakarības, lai aprēķinātu spiediena izmaiņas atkarībā no temperatūras, ļaujot precīzi projektēt un prognozēt sistēmas darbību.
Spiediena likuma matemātiskie lietojumi ietver tiešos proporcionalitātes aprēķinus P₁/T₁ = P₂/T₂, spiediena prognozēšanas formulas, termiskās izplešanās korekcijas un integrāciju ar termodinamikas vienādojumiem visaptverošai sistēmas analīzei.
Spiediena likuma pamatprincipu aprēķini
Matemātiskā pamatsakarība ļauj tieši aprēķināt spiediena izmaiņas atkarībā no temperatūras izmaiņām.
Primārais vienādojums:
P₁/T₁ = P₂/T₂
Pārkārtotas formas:
- P₂ = P₁ × (T₂/T₁) (aprēķina galīgo spiedienu)
- T₂ = T₁ × (P₂/P₁) (aprēķina galīgo temperatūru)
- P₁ = P₂ × (T₁/T₂) (aprēķina sākotnējo spiedienu)
Aprēķina piemērs:
Sākotnējie nosacījumi: P₁ = 100 PSI, T₁ = 293 K (20 °C)
Gala temperatūra: T₂ = 373 K (100°C)
Galīgais spiediens: P₂ = 100 × (373/293) = 127,3 PSI
Spiediena koeficienta aprēķini
Spiediena koeficients kvantitatīvi nosaka spiediena izmaiņu ātrumu atkarībā no temperatūras, kas ir būtisks termiskās sistēmas projektēšanā.
Spiediena koeficienta definīcija:
β = (1/P) × (∂P/∂T)_V = 1/T
Ideālām gāzēm: β = 1/T (pie nemainīga tilpuma)
Spiediena koeficienta lietojumprogrammas:
| Temperatūra (K) | Spiediena koeficients (K-¹) | Spiediena izmaiņas uz °C |
|---|---|---|
| 273 | 0.00366 | 0,366% uz °C |
| 293 | 0.00341 | 0,341% uz °C |
| 373 | 0.00268 | 0,268% uz °C |
| 573 | 0.00175 | 0,175% uz °C |
Termiskās izplešanās spiediena aprēķini
Ja gāzes tiek uzkarsētas slēgtās telpās, spiediena likums aprēķina radīto spiediena pieaugumu drošības un projektēšanas vajadzībām.
Slēgta gāzes apkure:
ΔP = P₁ × (ΔT/T₁)
kur ΔT ir temperatūras izmaiņas.
Drošības koeficienta aprēķini:
Aprēķina spiediens = darba spiediens × (T_max/T_ekspluatācijas) × drošības koeficients
Drošības aprēķina piemērs:
Darba apstākļi: 100 PSI pie 20 °C (293 K)
Maksimālā temperatūra: 150°C (423 K)
Drošības koeficients: 1,5
Aprēķina spiediens: 100 × (423/293) × 1,5 = 216,5 PSI.
Grafiskais attēlojums
Pareizi uzzīmējot spiediena likumu, tiek radītas lineāras sakarības, kas ļauj veikt grafisko analīzi un ekstrapolāciju.
Lineārā saistība:
P pret T (absolūtā temperatūra): Taisna līnija caur sākumpunktu
Slīpums = P/T = konstants
Grafiskās lietojumprogrammas:
- Tendenču analīze: Identificēt novirzes no ideālās uzvedības
- Ekstrapolācija: Prognozēt uzvedību ekstremālos apstākļos
- Datu validēšana: Eksperimentu rezultātu verifikācija
- Sistēmas optimizācija: Optimālo darbības apstākļu noteikšana
Integrācija ar termodinamikas vienādojumiem
Spiediena likums integrējas ar citām termodinamiskajām attiecībām, lai veiktu visaptverošu sistēmas analīzi.
Apvienojumā ar ideālās gāzes likumu:
PV = nRT apvienojumā ar P ∝ T sniedz pilnīgu gāzes uzvedības aprakstu
Termodinamiskā darba aprēķini:
Darbs = ∫P dV (apjoma izmaiņām)
Darbs = nR ∫T dV/V (ietver spiediena likumu)
Siltuma pārneses attiecības:
Q = nCᵥΔT (sildīšana ar konstantu tilpumu)
ΔP = (nR/V) × ΔT (spiediena palielināšanās sildīšanas rezultātā)
Kā spiediena likums ir piemērojams rūpnieciskajām siltuma sistēmām?
Spiediena likums regulē kritiski svarīgus rūpnieciskos lietojumus, kas saistīti ar temperatūras izmaiņām slēgtās gāzes sistēmās, sākot no spiedtvertnēm līdz termiskās apstrādes iekārtām.
Spiediena likums tiek izmantots spiedieniekārtu projektēšanā, termiskās drošības sistēmās, procesu apsildes aprēķinos un temperatūras kompensēšanā pneimatiskajās sistēmās, kur P₁/T₁ = P₂/T₂ nosaka spiediena reakciju uz termiskām izmaiņām.
Spiediena tvertņu projektēšanas lietojumprogrammas
Spiediena likums ir spiediena tvertnes konstrukcijas pamatā, nodrošinot drošu ekspluatāciju mainīgos temperatūras apstākļos.
Projektu spiediena aprēķini:
Aprēķina spiediens = maksimālais darba spiediens × (T_max/T_darbs)
Termiskās spriedzes analīze:
Kad gāze tiek uzkarsēta cietā traukā:
- Spiediena palielināšana: P₂ = P₁ × (T₂/T₁)
- Sienas spriegums: σ = P × r/t (plānsienu aproksimācija)
- Drošības rezerve: Termiskās izplešanās efekta ņemšana vērā
Dizaina piemērs:
Uzglabāšanas tvertne: 1000 l pie 100 PSI, 20°C
Maksimālā darba temperatūra: 80°C
Temperatūras attiecība: (80+273,15)/(20+273,15) = 353,15/293,15 = 1,205.
Aprēķina spiediens: 100 × 1,205 × 1,5 (drošības koeficients) = 180,7 PSI.
Termiskās apstrādes sistēmas
Rūpnieciskās termiskās apstrādes sistēmas izmanto spiediena likumu, lai kontrolētu un prognozētu spiediena izmaiņas sildīšanas un dzesēšanas ciklu laikā.
Procesa pieteikumi:
| Procesa veids | Temperatūras diapazons | Spiediena likuma piemērošana |
|---|---|---|
| Termiskā apstrāde | 200-1000°C | Krāsns atmosfēras spiediena kontrole |
| Ķīmiskie reaktori | 100-500°C | Reakcijas spiediena pārvaldība |
| Žāvēšanas sistēmas | 50-200°C | Tvaika spiediena aprēķini |
| Sterilizācija | 120-150°C | Tvaika spiediena attiecības |
Procesa kontroles aprēķini:
Spiediena iestatīšanas vērtība = bāzes spiediens × (procesa temperatūra/bāzes temperatūra)
Pneimatiskās sistēmas temperatūras kompensācija
Pneimatiskajām sistēmām ir nepieciešama temperatūras kompensācija, lai saglabātu nemainīgu veiktspēju dažādos vides apstākļos.
Temperatūras kompensācijas formula:
P_kompensētais = P_standarts × (T_aktuālais/T_standarts)
Kompensāciju pieteikumi:
- Piedziņas spēks: Uzturēt konsekventu spēka izvades jaudu
- Plūsmas kontrole: Kompensēt blīvuma izmaiņas
- Spiediena regulēšana: Pielāgojiet temperatūras iestatījumus
- Sistēmas kalibrēšana: Siltuma ietekmes ņemšana vērā
Kompensācijas piemērs:
Standarta nosacījumi: 100 PSI pie 20 °C (293,15 K)
Darba temperatūra: 50°C (323,15 K)
Kompensētais spiediens: 100 × (323,15/293,15) = 110,2 PSI.
Drošības sistēmas projektēšana
Spiediena likums ir izšķirošs drošības sistēmu, kas aizsargā pret termiskā pārspiediena apstākļiem, projektēšanā.
Drošības vārsta izmēra noteikšana:
Atbrīvošanas spiediens = darba spiediens × (T_max/T_darbs) × drošības koeficients
Drošības sistēmas komponenti:
- Spiediena pārspiediena vārsti: Novērst pārspiedienu no sildīšanas
- Temperatūras uzraudzība: Trases termiskie apstākļi
- Spiediena slēdži: Trauksmes signāls par pārmērīgu spiedienu
- Siltumizolācija: Temperatūras iedarbības kontrole
Siltummaiņa pielietojumi
Siltummaiņos izmanto spiediena likumu, lai prognozētu un kontrolētu spiediena izmaiņas, sildot vai dzesējot gāzes.
Siltummaiņa spiediena aprēķini:
ΔP_thermal = P_inlet × (T_outlet - T_inlet)/T_inlet
Dizaina apsvērumi:
- Spiediena kritums: Ņemiet vērā gan berzes, gan siltuma ietekmi.
- Paplašināšanas šuves: Pielāgojiet termisko izplešanos
- Spiediena novērtējums: Maksimāla termiskā spiediena konstrukcija
- Vadības sistēmas: Uzturēt optimālus spiediena apstākļus
Nesen sadarbojos ar vācu procesu inženieri Klausu Vēberu, kura termiskās apstrādes sistēmai radās spiediena kontroles problēmas. Pareizi piemērojot spiediena likumu un ieviešot temperatūras kompensētu spiediena kontroli, mēs uzlabojām procesa stabilitāti par 73% un par 85% samazinājām ar termiku saistīto iekārtu atteices.
Kāda ir spiediena likuma ietekme uz drošību?
Spiediena likumam ir būtiska ietekme uz drošību rūpnieciskās sistēmās, kur temperatūras paaugstināšanās var radīt bīstamus spiediena apstākļus, kas ir jāparedz un jākontrolē.
Spiediena likuma ietekme uz drošību ietver aizsardzību pret termisko pārspiedienu, spiediena samazināšanas sistēmu projektēšanu, temperatūras monitoringa prasības un avārijas procedūras termisko incidentu gadījumā, kad nekontrolēts karstums var izraisīt katastrofālu spiediena pieaugumu saskaņā ar P₂ = P₁ × (T₂/T₁).
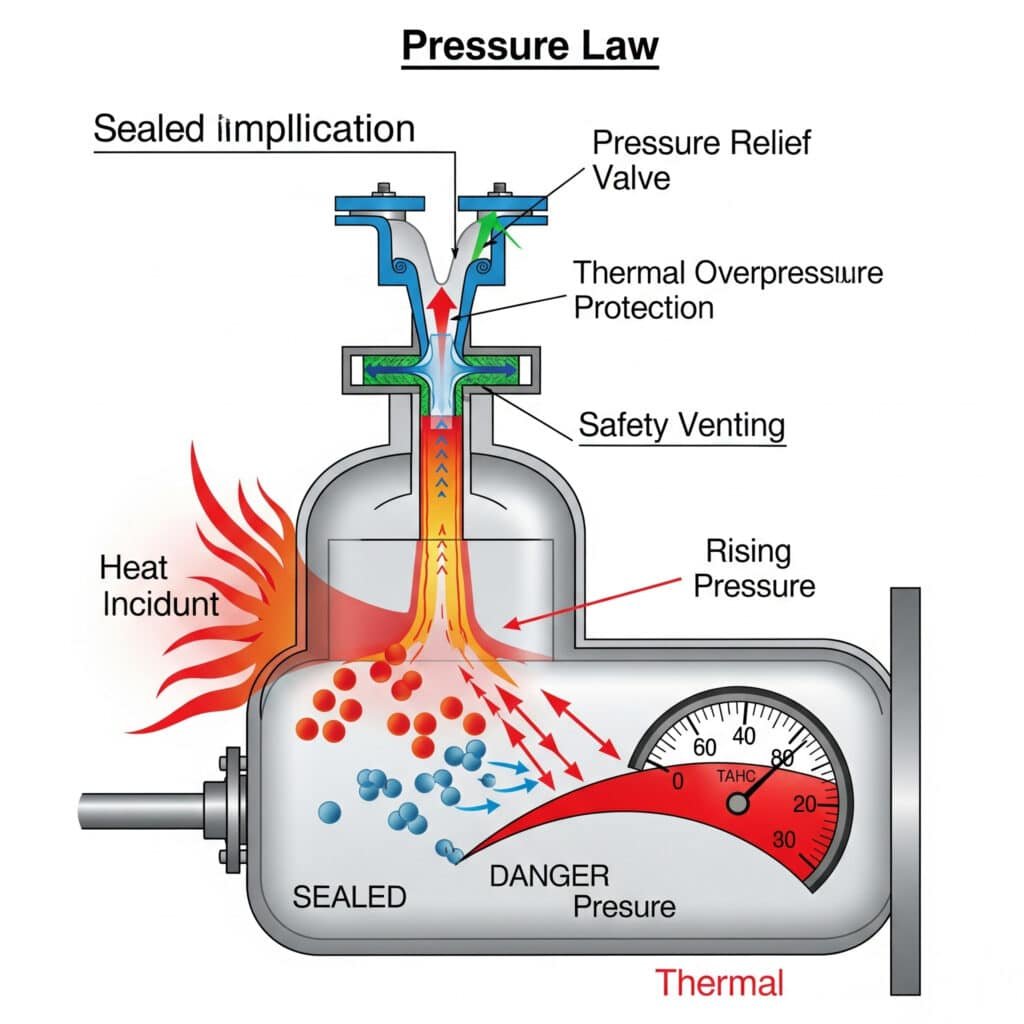
Termiskā pārspiediena draudi
Nekontrolēta temperatūras paaugstināšanās var radīt bīstamus spiediena apstākļus, kas pārsniedz iekārtu konstrukcijas robežas un rada drošības apdraudējumu.
Pārspiediena scenāriji:
| Scenārijs | Temperatūras paaugstināšanās | Spiediena palielināšana | Bīstamības līmenis |
|---|---|---|---|
| Uguns iedarbība | +500°C (293K līdz 793K) | +171% | Katastrofāls |
| Procesa traucējumi | +100°C (293K līdz 393K) | +34% | Smags |
| Saules apkure | +50°C (293K līdz 343K) | +17% | Mērens |
| Iekārtu darbības traucējumi | +200°C (293K līdz 493K) | +68% | Kritiskais |
Bojājumu veidi:
- Kuģa plīsums: Katastrofāls bojājums pārspiediena dēļ
- Blīvējuma atteice: Spiediena/temperatūras radīti blīvslēga un blīvējuma bojājumi.
- Cauruļvadu bojājums: Līnijas pārrāvums termiskās spriedzes dēļ
- Komponentu bojājumi: Aprīkojuma atteice no termiskās cikliskuma
Spiediena samazināšanas sistēmas konstrukcija
Spiediena samazināšanas sistēmās jāņem vērā termiskā spiediena palielināšanās, lai nodrošinātu atbilstošu aizsardzību pret pārspiediena apstākļiem.
Atbrīvošanas vārsta izmēra noteikšana:
Atbrīvošanas jauda = maksimālais termiskais spiediens × plūsmas koeficients
Siltuma reljefa aprēķini:
P_reljefs = P_darbs × (T_max/T_darbs) × 1,1 (10% rezerve)
Atbrīvošanas sistēmas komponenti:
- Primārais atvieglojums: Galvenais spiediena samazināšanas vārsts
- Sekundārais atvieglojums: Rezerves aizsardzības sistēma
- Plīstošie diski: Visaugstākā aizsardzība pret pārspiedienu
- Siltuma reljefs: Īpaša termiskās izplešanās aizsardzība
Temperatūras uzraudzība un kontrole
Efektīva temperatūras uzraudzība novērš bīstamu spiediena paaugstināšanos, konstatējot termiskos apstākļus, pirms tie kļūst bīstami.
Uzraudzības prasības:
- Temperatūras sensori: Nepārtraukta temperatūras mērīšana
- Spiediena sensori: Uzrauga spiediena palielināšanos
- Signalizācijas sistēmas: Operatoru brīdināšana par bīstamiem apstākļiem
- Automātiska izslēgšana: Avārijas sistēmas izolācija
Kontroles stratēģijas:
| Kontroles metode | Reakcijas laiks | Efektivitāte | Pieteikumi |
|---|---|---|---|
| Temperatūras trauksmes signāli | Sekundes | Augsts | Agrīnā brīdināšana |
| Spiediena bloķētāji | Milisekundes | Ļoti augsts | Avārijas izslēgšana |
| Dzesēšanas sistēmas | Protokols | Mērens | Temperatūras kontrole |
| Izolācijas vārsti | Sekundes | Augsts | Sistēmas izolācija |
Ārkārtas reaģēšanas procedūras
Lai nodrošinātu drošu reakciju un sistēmas izslēgšanu, avārijas procedūrās jāņem vērā spiediena likuma ietekme termisko incidentu laikā.
Ārkārtas situāciju scenāriji:
- Uguns iedarbība: Strauja temperatūras un spiediena paaugstināšanās
- Dzesēšanas sistēmas atteice: Pakāpeniska temperatūras paaugstināšanās
- Bēguļojoša reakcija: Ātra siltuma un spiediena palielināšanās
- Ārējā apsilde: Saules vai siltuma starojuma iedarbība
Reaģēšanas procedūras:
- Tūlītēja izolācija: Apstādināt siltuma padeves avotus
- Spiediena samazināšana: Aktivizēt atvieglojumu sistēmas
- Dzesēšanas uzsākšana: Piemērot ārkārtas dzesēšanu
- Sistēmas spiediena samazināšana: Droša spiediena samazināšana
- Platības evakuācija: Aizsargāt personālu
Tiesību aktu atbilstība
Drošības noteikumi paredz, ka sistēmas projektēšanā un ekspluatācijā jāņem vērā termiskā spiediena ietekme.
Normatīvās prasības:
- ASME katlu kodekss5: Spiediena tvertnes termiskā konstrukcija
- API standarti: Procesu iekārtu termiskā aizsardzība
- OSHA noteikumi: Darbinieku drošība siltumapgādes sistēmās
- Vides noteikumi: Droša termiskā izlāde
Atbilstības stratēģijas:
- Dizaina standarti: Ievērojiet atzītus siltuma konstrukcijas kodeksus
- Drošības analīze: Veikt termiskā apdraudējuma analīzi
- Dokumentācija: Uzturēt termiskās drošības uzskaiti
- Apmācība: Izglīto darbiniekus par termiskiem apdraudējumiem
Risku novērtēšana un pārvaldība
Visaptverošā riska novērtējumā jāiekļauj termiskā spiediena ietekme, lai identificētu un mazinātu iespējamos apdraudējumus.
Riska novērtēšanas process:
- Bīstamības identificēšana: Identificēt termiskā spiediena avotus
- Sekseņu analīze: Novērtēt iespējamos rezultātus
- Iespējamības novērtējums: Noteikt iespējamību, ka tas var notikt
- Riska klasifikācija: Prioritāšu noteikšana risku mazināšanai
- Seku mazināšanas stratēģijas: Īstenot aizsardzības pasākumus
Riska mazināšanas pasākumi:
- Dizaina robežas: Lielgabarīta iekārtas siltuma efektiem
- Aizsardzības dublēšana: Vairākas drošības sistēmas
- Profilaktiskā apkope: Regulāra sistēmas pārbaude
- Operatoru apmācība: Izpratne par termisko drošību
- Ārkārtas situāciju plānošana: Termisku incidentu novēršanas procedūras
Kā spiediena likums integrējas ar citiem gāzes likumiem?
Spiediena likums integrējas ar citiem gāzes pamatlikumiem, veidojot visaptverošu izpratni par gāzes uzvedību un radot pamatu modernai termodinamikas analīzei.
Spiediena likums integrējas ar Boila likumu (P₁V₁ = P₂V₂), Čārlza likumu (V₁/T₁ = V₂/T₂) un Avogadro likumu, veidojot kombinēto gāzes likumu un ideālās gāzes vienādojumu PV = nRT, kas nodrošina pilnīgu gāzes uzvedības aprakstu.
Kombinētā gāzes likuma integrācija
Spiediena likums apvienojas ar citiem gāzes likumiem, lai izveidotu visaptverošu kombinēto gāzes likumu, kas apraksta gāzes uzvedību, ja mainās vairākas īpašības vienlaicīgi.
Kombinētais gāzes likums:
(P₁V₁)/T₁ = (P₂V₂)/T₂
Šis vienādojums ietver:
- Spiediena likums: P₁/T₁ = P₂/T₂ (konstants tilpums)
- Boila likums: P₁V₁ = P₂V₂ (konstanta temperatūra)
- Čārlza likums: V₁/T₁ = V₂/T₂ (konstants spiediens)
Individuālo tiesību atvasināšana:
No kombinētā gāzes likuma:
- Iestatiet V₁ = V₂ → P₁/T₁ = P₂/T₂ (spiediena likums).
- Uzstādīt T₁ = T₂ → P₁V₁ = P₂V₂ (Boila likums).
- Uzstādīt P₁ = P₂ → V₁/T₁ = V₂/T₂ (Charlesa likums).
Ideālās gāzes likuma attīstība
Spiediena likums papildina ideālās gāzes likumu, kas ir visplašākais gāzes uzvedības apraksts.
Ideālās gāzes likums:
PV = nRT
Atvasinājums no gāzes likumiem:
- Boila likums: P ∝ 1/V (konstante T, n)
- Čārlza likums: V ∝ T (konstante P, n)
- Spiediena likums: P ∝ T (konstanta V, n)
- Avogadro likums: V ∝ n (konstanta P, T)
Kombinēti: PV ∝ nT → PV = nRT
Termodinamisko procesu integrācija
Spiediena likums integrējas ar termodinamikas procesiem, lai aprakstītu gāzes uzvedību dažādos apstākļos.
Procesu veidi:
| Process | Nemainīgs īpašums | Spiediena likuma piemērošana |
|---|---|---|
| Izohoriskais | Tilpums | Tiešā piemērošana: P ∝ T |
| Izobārais | Spiediens | Apvienojumā ar Čārlza likumu |
| Izotermiskais | Temperatūra | Nav tiešas piemērošanas |
| Adiabatic | Nav siltuma pārneses | Modificētas attiecības |
Izohoriskais process (konstants tilpums):
P₁/T₁ = P₂/T₂ (tieša spiediena likuma piemērošana)
Darbs = 0 (bez apjoma izmaiņām)
Q = nCᵥΔT (siltums ir vienāds ar iekšējās enerģijas izmaiņām)
Reālās gāzes uzvedības integrācija
Spiediena likums attiecas arī uz reālo gāzu uzvedību, izmantojot stāvokļa vienādojumus, kuros ņemta vērā molekulu mijiedarbība un galīgais molekulu izmērs.
Van der Valsa vienādojums:
(P + a/V²)(V - b) = RT
Kur:
- a = starpmolekulārās pievilkšanās korekcija
- b = Molekulārā tilpuma korekcija
Reālā gāzes spiediena likums:
P_real = RT/(V-b) - a/V²
Spiediena likums joprojām ir spēkā, bet ar korekcijām, kas ņem vērā reālo gāzes uzvedību.
Kinētiskās teorijas integrācija
Spiediena likums integrējas ar kinētisko molekulu teoriju, lai sniegtu mikroskopisku izpratni par makroskopisku gāzes uzvedību.
Kinētiskās teorijas sakarības:
P = (1/3)nmv̄² (mikroskopiskais spiediens)
v̄² ∝ T (ātruma un temperatūras attiecība)
Tāpēc: P ∝ T (spiediena likums no kinētiskās teorijas)
Integrācijas priekšrocības:
- Mikroskopiskā izpratne: Makroskopisko likumu molekulārais pamats
- Prognozēšanas spējas: Uzvedības prognozēšana no pirmajiem principiem
- Ierobežojumu identifikācija: Nosacījumi, kuros tiesību akti netiek ievēroti
- Uzlabotas lietojumprogrammas: Kompleksu sistēmu analīze
Nesen sadarbojos ar Dienvidkorejas inženieri Park Min-jun, kura izstrādātajai daudzpakāpju kompresijas sistēmai bija nepieciešama integrēta gāzes likumu analīze. Pareizi piemērojot spiediena likumu kombinācijā ar citiem gāzes likumiem, mēs optimizējām sistēmas konstrukciju, lai panāktu 43% enerģijas samazinājumu, vienlaikus uzlabojot veiktspēju par 67%.
Praktiski integrācijas lietojumprogrammas
Integrētās gāzes tiesību lietojumprogrammās tiek risinātas sarežģītas rūpnieciskas problēmas, kas saistītas ar vairākiem mainīgiem mainīgajiem lielumiem un apstākļiem.
Daudzvariantu problēmas:
- Vienlaicīgas P, V, T izmaiņas: Izmantojiet kombinēto gāzes likumu
- Procesa optimizācija: Piemērot atbilstošas likumu kombinācijas
- Drošības analīze: Apsveriet visas iespējamās mainīgo lielumu izmaiņas
- Sistēmas izstrāde: Integrēt vairākus gāzes likuma efektus
Inženiertehniskie lietojumi:
- Kompresora konstrukcija: Spiediena un tilpuma ietekmes integrēšana
- Siltummaiņa analīze: Siltuma un spiediena ietekmes apvienošana
- Procesa kontrole: Integrēto attiecību izmantošana kontrolei
- Drošības sistēmas: Visu gāzes likumu mijiedarbību ņemšana vērā
Secinājums
Spiediena likums (Geja-Lušaka likums) nosaka, ka gāzes spiediens ir tieši proporcionāls absolūtajai temperatūrai pie nemainīga tilpuma (P₁/T₁ = P₂/T₂), nodrošinot būtisku izpratni siltumtehnisko sistēmu projektēšanā, drošības analīzē un rūpniecisko procesu kontrolē, kur temperatūras izmaiņas ietekmē spiediena apstākļus.
Biežāk uzdotie jautājumi par spiediena likumu fizikā
Kas ir spiediena likums fizikā?
Spiediena likums, pazīstams arī kā Gajs-Lušaka likums, nosaka, ka gāzes spiediens ir tieši proporcionāls tās absolūtajai temperatūrai, ja tilpums un daudzums paliek nemainīgi, izteikts kā P₁/T₁ = P₂/T₂ jeb P ∝ T.
Kā spiediena likums ir saistīts ar molekulu uzvedību?
Spiediena likums atspoguļo molekulu kinētisko teoriju, kurā augstāka temperatūra palielina molekulu ātrumu un sadursmju intensitāti ar tvertnes sieniņām, radot augstāku spiedienu biežāku un spēcīgāku molekulu triecienu rezultātā.
Kādi ir spiediena likuma matemātiskie lietojumi?
Matemātiskie lietojumi ietver spiediena izmaiņu atkarībā no temperatūras aprēķināšanu (P₂ = P₁ × T₂/T₁), spiediena koeficientu (β = 1/T) noteikšanu un termiskās drošības sistēmu projektēšanu ar atbilstošām spiediena rezervēm.
Kā spiediena likums attiecas uz darba drošību?
Rūpnieciskās drošības lietojumi ietver pārspiediena vārstu izmēru noteikšanu, termisko aizsardzību pret pārspiedienu, temperatūras monitoringa sistēmas un avārijas procedūras termisko incidentu gadījumos, kas var izraisīt bīstamu spiediena paaugstināšanos.
Kāda ir atšķirība starp spiediena likumu un citiem gāzes likumiem?
Spiediena likums attiecas uz spiedienu un temperatūru pie nemainīga tilpuma, Boila likums attiecas uz spiedienu un tilpumu pie nemainīgas temperatūras, bet Čārlza likums attiecas uz tilpumu un temperatūru pie nemainīga spiediena.
Kā spiediena likums integrējas ar ideālās gāzes likumu?
Spiediena likums kopā ar citiem gāzes likumiem veido ideālās gāzes vienādojumu PV = nRT, kurā spiediena un temperatūras attiecība (P ∝ T) ir viena no visaptverošā gāzes uzvedības apraksta sastāvdaļām.
-
Sniegts detalizēts skaidrojums par Gejas-Lušaka likumu, kas ir viens no fizikas pamatlikumiem par gāzēm un apraksta tiešo sakarību starp gāzes spiedienu un absolūto temperatūru pie nemainīga tilpuma. ↩
-
Paskaidro jēdzienu par absolūtās temperatūras skalu, piemēram, Kelvina skalu, kas sākas no absolūtās nulles - teorētiskā punkta, kurā daļiņām ir minimāla vibrācijas kustība, kas ir būtiska prasība gāzes likumu aprēķinos. ↩
-
Piedāvā pārskatu par gāzu kinētisko teoriju - zinātnisko modeli, kas izskaidro gāzu makroskopiskās īpašības (piemēram, spiedienu un temperatūru), ņemot vērā gāzu sastāvā esošo molekulu kustību un mijiedarbību. ↩
-
Apraksta Maksvela-Bolcmaņa sadalījumu, statistiskās mehānikas varbūtības sadalījumu, kas nosaka daļiņu ātrumu sadalījumu gāzē noteiktā temperatūrā un ir gāzes kinētiskās teorijas galvenā daļa. ↩
-
Sniedz informāciju par ASME Katlu un spiedtvertņu kodeksu (BPVC), kas ir galvenais standarts, kurš reglamentē katlu un spiedtvertņu projektēšanu, būvniecību un pārbaudi, lai nodrošinātu drošību, tostarp ņemot vērā termisko spiediena ietekmi. ↩



