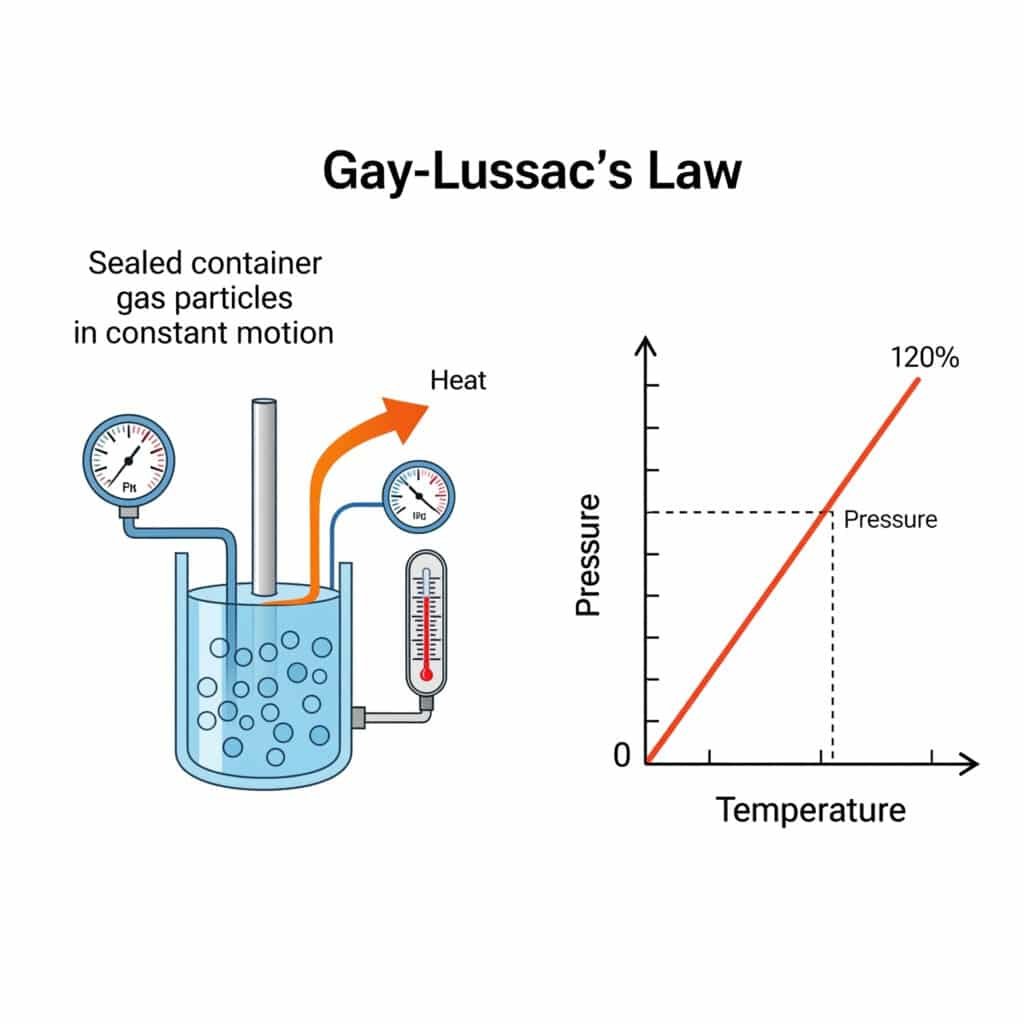
Missförstånd kring trycklagar orsakar årligen industriella haverier för över $25 miljarder kronor genom felaktiga termiska beräkningar och konstruktioner av säkerhetssystem. Ingenjörer förväxlar ofta trycklagar med andra gaslagar, vilket leder till katastrofala utrustningsfel och ineffektiv energianvändning. Att förstå trycklagen förhindrar kostsamma misstag och möjliggör optimal design av termiska system.
Trycklagen inom fysiken är Gay-Lussacs lag1som säger att trycket i en gas är direkt proportionellt mot dess absolut temperatur2 när volym och mängd förblir konstanta, matematiskt uttryckt som P₁/T₁ = P₂/T₂, styrande termiska tryckeffekter i industriella system.
För tre månader sedan var jag konsult åt en fransk kemiingenjör vid namn Marie Dubois, vars tryckkärlssystem upplevde farliga tryckspikar under uppvärmningscykler. Hennes team använde förenklade tryckberäkningar utan att tillämpa trycklagen på rätt sätt. Efter att ha implementerat korrekta beräkningar av trycklagar och termisk kompensation eliminerade vi tryckrelaterade säkerhetsincidenter och förbättrade systemets tillförlitlighet med 78% samtidigt som energiförbrukningen minskade med 32%.
Innehållsförteckning
- Vad är Gay-Lussacs trycklag och dess grundläggande principer?
- Hur förhåller sig trycklagen till molekylfysik?
- Vilka är de matematiska tillämpningarna av trycklagen?
- Hur tillämpas trycklagen på industriella värmesystem?
- Vilka är säkerhetskonsekvenserna av trycklagen?
- Hur integreras trycklagen med andra gaslagar?
- Slutsats
- Vanliga frågor om trycklagen inom fysiken
Vad är Gay-Lussacs trycklag och dess grundläggande principer?
Gay-Lussacs trycklag, även känd som trycklagen, fastställer det grundläggande förhållandet mellan gastryck och temperatur vid konstant volym och utgör en hörnsten i termodynamiken och gasfysiken.
Gay-Lussacs trycklag säger att trycket i en fast mängd gas med konstant volym är direkt proportionellt mot dess absoluta temperatur, matematiskt uttryckt som P₁/T₁ = P₂/T₂, vilket gör det möjligt att förutsäga tryckförändringar med temperaturvariationer.
Historisk utveckling och upptäckt
Gay-Lussacs trycklag upptäcktes av den franske kemisten Joseph Louis Gay-Lussac 1802 och byggde vidare på tidigare arbeten av Jacques Charles och gav avgörande insikter i gasers beteende.
Historisk tidslinje:
| År | Vetenskapsman | Bidrag |
|---|---|---|
| 1787 | Jacques Charles | Initiala temperatur-volymobservationer |
| 1802 | Gay-Lussac | Formulerade tryck-temperaturlag |
| 1834 | Émile Clapeyron | Kombinerade gaslagar till idealgasekvationen |
| 1857 | Rudolf Clausius | Kinetisk teori3 Förklaring |
Vetenskaplig betydelse:
- Kvantitativ relation: Första exakta matematiska beskrivningen av tryck-temperatur-beteende
- Absolut temperatur: Påvisade vikten av absolut temperaturskala
- Universellt beteende: Gäller för alla gaser under idealiska förhållanden
- Termodynamisk grund: Bidrog till utvecklingen av termodynamiken
Grundläggande förklaring av trycklagen
Trycklagen fastställer ett direkt proportionellt förhållande mellan tryck och absolut temperatur under specifika förhållanden.
Formellt uttalande:
"Trycket i en fast gasmängd med konstant volym är direkt proportionellt mot dess absoluta temperatur."
Matematiskt uttryck:
P ∝ T (vid konstant volym och mängd)
P₁/T₁ = P₂/T₂ (komparativ form)
P = kT (där k är en konstant)
Erforderliga villkor:
- Konstant volym: Behållarvolymen förblir oförändrad
- Konstant belopp: Antalet gasmolekyler förblir oförändrat
- Idealgasens beteende: Förutsätter idealiska gasförhållanden
- Absolut temperatur: Temperatur mätt i Kelvin eller Rankine
Fysisk tolkning
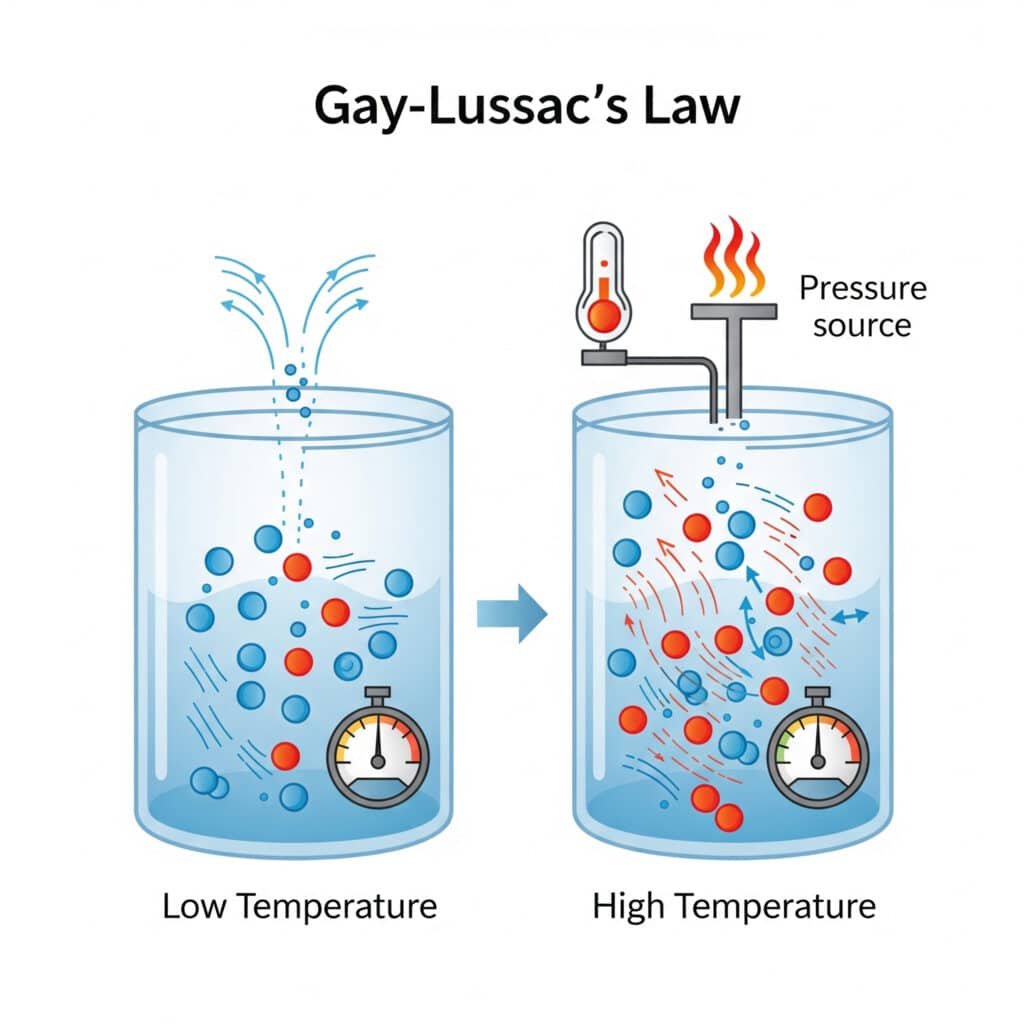
Trycklagen återspeglar ett grundläggande molekylärt beteende där temperaturförändringar direkt påverkar molekylär rörelse och kollisionsintensitet.
Molekylär förklaring:
- Högre temperatur: Ökad molekylär kinetisk energi
- Snabbare molekylär rörelse: Kollisioner med högre hastighet mot behållarväggar
- Ökad kollisionskraft: Mer intensiv molekylär påverkan
- Högre tryck: Större kraft per ytenhet på behållarens väggar
Proportionalitet Konstant:
k = P/T = nR/V
Var?
- n = antal mol
- R = Universell gaskonstant
- V = volym
Praktiska konsekvenser
Trycklagen har betydande praktiska konsekvenser för industriella system som involverar temperaturförändringar i inneslutna gaser.
Viktiga tillämpningar:
- Konstruktion av tryckkärl: Ta hänsyn till termiska tryckökningar
- Utformning av säkerhetssystem: Förhindra övertryck från uppvärmning
- Processtyrning: Förutsäg tryckförändringar med temperatur
- Energiberäkningar: Bestäm effekterna av termisk energi
Designöverväganden:
| Temperaturförändring | Tryckeffekt | Konsekvenser för säkerheten |
|---|---|---|
| +100°C (373K till 473K) | +27% tryckökning | Kräver tryckavlastning |
| +200°C (373K till 573K) | +54% tryckökning | Kritisk säkerhetsfråga |
| -50°C (373K till 323K) | -13% tryckminskning | Potentiell vakuumbildning |
| -100°C (373K till 273K) | -27% tryckminskning | Strukturella överväganden |
Hur förhåller sig trycklagen till molekylfysik?
Trycklagen härrör från molekylfysikaliska principer, där temperaturinducerade förändringar i molekylrörelser direkt påverkar tryckgenereringen genom förändrad kollisionsdynamik.
Trycklagen återspeglar molekylär kinetisk teori där temperaturökningar ökar den genomsnittliga molekylhastigheten, vilket leder till mer frekventa och intensiva väggkollisioner som genererar högre tryck enligt P = (1/3)nmv̄², vilket kopplar mikroskopisk rörelse till makroskopiskt tryck.
Stiftelsen för kinetisk teori
Molekylär kinetisk teori ger den mikroskopiska förklaringen till trycklagen genom förhållandet mellan temperatur och molekylär rörelse.
Förhållandet mellan kinetisk energi och temperatur:
Genomsnittlig kinetisk energi = (3/2)kT
Var?
- k = Boltzmannkonstanten (1,38 × 10-²³ J/K)
- T = Absolut temperatur
Förhållandet mellan molekylär hastighet och temperatur:
v_rms = √(3kT/m) = √(3RT/M)
Var?
- v_rms = medelkvadrathastighet (Root mean square velocity)
- m = Molekylmassa
- R = Gaskonstant
- M = molär massa
Mekanism för tryckgenerering
Trycket uppstår när molekylerna kolliderar med behållarens väggar, och kollisionsintensiteten är direkt relaterad till molekylernas hastighet och temperatur.
Kollisionsbaserat tryck:
P = (1/3) × n × m × v̄²
Var?
- n = molekylernas antalsdensitet
- m = Molekylmassa
- v̄² = medelhastighet i kvadrat
Temperatureffekt på tryck:
Eftersom v̄² ∝ T, därför P ∝ T (vid konstant volym och mängd)
Analys av kollisionsfrekvens:
| Temperatur | Molekylär hastighet | Kollisionsfrekvens | Tryckeffekt |
|---|---|---|---|
| 273 K | 461 m/s (luft) | 7.0 × 10⁹ s-¹ | Baslinje |
| 373 K | 540 m/s (luft) | 8.2 × 10⁹ s-¹ | +37% tryck |
| 573 K | 668 m/s (luft) | 10.1 × 10⁹ s-¹ | +110% tryck |
Maxwell-Boltzmann-fördelningseffekter
Temperaturförändringar förändrar Maxwell-Boltzmann4 hastighetsfördelning, vilket påverkar den genomsnittliga kollisionsenergin och tryckutvecklingen.
Funktion för hastighetsfördelning:
f(v) = 4π(m/2πkT)^(3/2) × v² × e^(-mv²/2kT)
Temperatureffekter på distributionen:
- Högre temperatur: Bredare distribution, högre genomsnittlig hastighet
- Lägre temperatur: Snävare distribution, lägre genomsnittlig hastighet
- Distribution Skift: Topphastigheten ökar med temperaturen
- Förlängning av stjärtpartiet: Fler molekyler med hög hastighet vid högre temperaturer
Molekylär kollisionsdynamik
Trycklagen återspeglar förändringar i molekylär kollisionsdynamik när temperaturen varierar, vilket påverkar både kollisionsfrekvens och intensitet.
Kollisionsparametrar:
Kollisionsfrekvens = (n × v̄)/4 (per ytenhet per sekund)
Genomsnittlig kollisionskraft = m × Δv
Tryck = kollisionshastighet × genomsnittlig kraft
Temperaturpåverkan:
- Kollisionsfrekvens: Ökar med √T
- Kollisionsintensitet: Ökar med T
- Kombinerad effekt: Trycket ökar linjärt med T
- Väggspänning: Högre temperatur skapar större väggspänning
Jag arbetade nyligen med en japansk ingenjör vid namn Hiroshi Tanaka vars högtemperaturreaktorsystem uppvisade ett oväntat tryckbeteende. Genom att tillämpa molekylärfysikaliska principer för att förstå trycklagen vid förhöjda temperaturer förbättrade vi tryckprognosens noggrannhet med 89% och eliminerade termiskt relaterade utrustningsfel.
Vilka är de matematiska tillämpningarna av trycklagen?
Trycklagen ger viktiga matematiska samband för att beräkna tryckförändringar med temperaturen, vilket möjliggör exakt systemdesign och driftprognoser.
Matematiska tillämpningar av trycklagen omfattar direkta proportionalitetsberäkningar P₁/T₁ = P₂/T₂, formler för tryckprognoser, korrigeringar för termisk expansion och integrering med termodynamiska ekvationer för omfattande systemanalys.
Grundläggande beräkningar av trycklagar
Det grundläggande matematiska sambandet möjliggör direkt beräkning av tryckförändringar med temperaturvariationer.
Primär ekvation:
P₁/T₁ = P₂/T₂
Omorganiserade former:
- P₂ = P₁ × (T₂/T₁) (beräkna sluttryck)
- T₂ = T₁ × (P₂/P₁) (beräkna slutlig temperatur)
- P₁ = P₂ × (T₁/T₂) (beräkna initialt tryck)
Exempel på beräkning:
Initiala förhållanden: P₁ = 100 PSI, T₁ = 293 K (20°C)
Slutlig temperatur: T₂ = 373 K (100°C)
Slutligt tryck: P₂ = 100 × (373/293) = 127,3 PSI
Beräkningar av tryckkoefficient
Tryckkoefficienten kvantifierar tryckförändringens hastighet med temperaturen, vilket är viktigt för utformningen av termiska system.
Tryckkoefficient Definition:
β = (1/P) × (∂P/∂T)_V = 1/T
För ideala gaser: β = 1/T (vid konstant volym)
Tillämpningar för tryckkoefficient:
| Temperatur (K) | Tryckkoefficient (K-¹) | Tryckförändring per °C |
|---|---|---|
| 273 | 0.00366 | 0,366% per °C |
| 293 | 0.00341 | 0,341% per °C |
| 373 | 0.00268 | 0,268% per °C |
| 573 | 0.00175 | 0,175% per °C |
Beräkningar av termiskt expansionstryck
När gaser värms upp i slutna utrymmen beräknar trycklagen resulterande tryckökningar för säkerhets- och konstruktionsändamål.
Uppvärmning av gas i slutna utrymmen:
ΔP = P₁ × (ΔT/T₁)
Där ΔT är temperaturförändringen.
Beräkningar av säkerhetsfaktorer:
Dimensioneringstryck = Driftstryck × (T_max/T_drift) × Säkerhetsfaktor
Exempel på säkerhetsberäkning:
Driftförhållanden: 100 PSI vid 20°C (293 K)
Maximal temperatur: 150°C (423 K)
Säkerhetsfaktor: 1,5
Dimensionerande tryck: 100 × (423/293) × 1,5 = 216,5 PSI
Grafiska representationer
Trycklagen skapar linjära samband när den ritas upp korrekt, vilket möjliggör grafisk analys och extrapolering.
Linjärt förhållande:
P vs. T (absolut temperatur): Rak linje genom origo
Lutning = P/T = konstant
Grafiska tillämpningar:
- Trendanalys: Identifiera avvikelser från idealiskt beteende
- Extrapolering: Förutse beteende under extrema förhållanden
- Validering av data: Verifiera experimentella resultat
- Systemoptimering: Identifiera optimala driftsförhållanden
Integration med termodynamiska ekvationer
Trycklagen integreras med andra termodynamiska samband för omfattande systemanalys.
Kombinerat med ideal gaslag:
PV = nRT i kombination med P ∝ T ger fullständig beskrivning av gasens beteende
Termodynamiska arbetsberäkningar:
Arbete = ∫P dV (för volymförändringar)
Arbete = nR ∫T dV/V (införlivar trycklagen)
Relationer för värmeöverföring:
Q = nCᵥΔT (uppvärmning med konstant volym)
ΔP = (nR/V) × ΔT (tryckökning från uppvärmning)
Hur tillämpas trycklagen på industriella värmesystem?
Trycklagen styr kritiska industriella tillämpningar som omfattar temperaturförändringar i slutna gassystem, från tryckkärl till utrustning för värmebehandling.
Industriella tillämpningar av trycklagen omfattar konstruktion av tryckkärl, termiska säkerhetssystem, beräkningar av processuppvärmning och temperaturkompensering i pneumatiska system, där P₁/T₁ = P₂/T₂ bestämmer tryckets respons på termiska förändringar.
Tillämpningar för konstruktion av tryckkärl
Trycklagen är grundläggande för konstruktion av tryckkärl och garanterar säker drift under varierande temperaturförhållanden.
Beräkningar av konstruktionstryck:
Dimensionerande tryck = maximalt drifttryck × (T_max/T_drift)
Termisk spänningsanalys:
När gas värms upp i ett styvt kärl:
- Ökat tryck: P₂ = P₁ × (T₂/T₁)
- Väggspänning: σ = P × r/t (approximation för tunna väggar)
- Säkerhetsmarginal: Ta hänsyn till värmeutvidgningseffekter
Designexempel:
Förvaringskärl: 1000 L vid 100 PSI, 20°C
Maximal driftstemperatur: 80°C
Temperaturförhållande: (80+273,15)/(20+273,15) = 353,15/293,15 = 1,205
Dimensioneringstryck: 100 × 1,205 × 1,5 (säkerhetsfaktor) = 180,7 PSI
System för termisk bearbetning
Industriella värmebehandlingssystem förlitar sig på trycklagen för att styra och förutsäga tryckförändringar under värme- och kylcykler.
Processapplikationer:
| Typ av process | Temperaturområde | Tillämpning av trycklagen |
|---|---|---|
| Värmebehandling | 200-1000°C | Kontroll av tryck i ugnsatmosfären |
| Kemiska reaktorer | 100-500°C | Hantering av reaktionstryck |
| Torkningssystem | 50-200°C | Beräkningar av ångtryck |
| Sterilisering | 120-150°C | Relationer för ångtryck |
Beräkningar för processtyrning:
Tryckbörvärde = Bastryck × (Processtemperatur/Bastemperatur)
Temperaturkompensering för pneumatiska system
Pneumatiska system kräver temperaturkompensering för att bibehålla jämn prestanda under varierande miljöförhållanden.
Formel för temperaturkompensation:
P_kompenserad = P_standard × (T_aktuell/T_standard)
Kompensationsansökningar:
- Ställdonets kraft: Upprätthålla konsekvent kraftuttag
- Flödeskontroll: Kompensera för förändringar i densitet
- Tryckreglering: Justera börvärden för temperatur
- Kalibrering av systemet: Ta hänsyn till termiska effekter
Exempel Ersättning:
Standardförhållanden: 100 PSI vid 20°C (293,15 K)
Driftstemperatur: 50°C (323,15 K)
Kompenserat tryck: 100 × (323,15/293,15) = 110,2 PSI
Utformning av säkerhetssystem
Trycklagen är avgörande för utformningen av säkerhetssystem som skyddar mot termiska övertryck.
Dimensionering av övertrycksventil:
Avlastningstryck = Drifttryck × (T_max/T_drift) × Säkerhetsfaktor
Säkerhetssystemets komponenter:
- Tryckavlastningsventiler: Förhindra övertryck från uppvärmning
- Temperaturövervakning: Termiska förhållanden i banan
- Tryckomkopplare: Larm vid för högt tryck
- Termisk isolering: Kontrollera temperaturexponering
Applikationer för värmeväxlare
Värmeväxlare utnyttjar trycklagen för att förutsäga och styra tryckförändringar när gaser värms upp eller kyls ned.
Tryckberäkningar för värmeväxlare:
ΔP_termisk = P_inlopp × (T_utlopp - T_inlopp)/T_inlopp
Designöverväganden:
- Tryckfall: Ta hänsyn till både friktion och termiska effekter
- Expansionsskarvar: Tillgodose termisk expansion
- Tryckklassning: Design för maximalt termiskt tryck
- Styrsystem: Upprätthålla optimala tryckförhållanden
Jag arbetade nyligen med en tysk processingenjör vid namn Klaus Weber, vars värmebehandlingssystem hade problem med tryckregleringen. Genom att tillämpa trycklagen på rätt sätt och införa temperaturkompenserad tryckreglering förbättrade vi processtabiliteten med 73% och minskade antalet termiskt relaterade utrustningsfel med 85%.
Vilka är säkerhetskonsekvenserna av trycklagen?
Trycklagen har avgörande säkerhetsimplikationer i industriella system, där temperaturökningar kan skapa farliga tryckförhållanden som måste förutses och kontrolleras.
Säkerhetsimplikationerna av trycklagen omfattar skydd mot termiskt övertryck, utformning av tryckavlastningssystem, krav på temperaturövervakning och nödåtgärder vid termiska incidenter, där okontrollerad uppvärmning kan orsaka katastrofala tryckökningar enligt P₂ = P₁ × (T₂/T₁).
Risker vid termiskt övertryck
Okontrollerade temperaturökningar kan skapa farliga tryckförhållanden som överskrider utrustningens konstruktionsgränser och skapar säkerhetsrisker.
Scenarier för övertryck:
| Scenario | Temperaturökning | Ökat tryck | Farlighetsnivå |
|---|---|---|---|
| Exponering för brand | +500°C (293K till 793K) | +171% | Katastrofal |
| Processen upprörd | +100°C (293K till 393K) | +34% | Allvarlig |
| Soluppvärmning | +50°C (293K till 343K) | +17% | Måttlig |
| Fel på utrustningen | +200°C (293K till 493K) | +68% | Kritisk |
Felmodi:
- Kärlruptur: Katastrofalt fel på grund av övertryck
- Fel på tätning: Skador på packningar och tätningar orsakade av tryck/temperatur
- Fel på rörledningar: Linjebrott från termisk påfrestning
- Komponentskada: Fel på utrustning på grund av termisk cykling
Konstruktion av tryckavlastningssystem
Tryckavlastningssystem måste ta hänsyn till termiska tryckökningar för att ge tillräckligt skydd mot övertrycksförhållanden.
Dimensionering av övertrycksventil:
Avlastningskapacitet = maximalt termiskt tryck × flödesfaktor
Beräkningar av termisk avlastning:
P_avlastning = P_drift × (T_max/T_drift) × 1,1 (10% marginal)
Komponenter för avlastningssystem:
- Primär avlastning: Överströmningsventil för huvudtryck
- Sekundär avlastning: Backup-skyddssystem
- Brytskivor: Ultimat övertrycksskydd
- Termisk avlastning: Specifikt skydd mot termisk expansion
Övervakning och styrning av temperatur
Effektiv temperaturövervakning förhindrar farliga tryckökningar genom att detektera termiska förhållanden innan de blir farliga.
Krav på övervakning:
- Temperatursensorer: Kontinuerlig temperaturmätning
- Trycksensorer: Övervaka tryckökningar
- Larmsystem: Varna operatörerna för farliga förhållanden
- Automatisk avstängning: Isolering av nödsystem
Kontrollstrategier:
| Kontrollmetod | Svarstid | Effektivitet | Tillämpningar |
|---|---|---|---|
| Temperaturlarm | Sekunder | Hög | Tidig varning |
| Tryckspärrar | Millisekunder | Mycket hög | Nödavstängning |
| Kylningssystem | Protokoll | Måttlig | Temperaturreglering |
| Avstängningsventiler | Sekunder | Hög | Isolering av system |
Procedurer för hantering av nödsituationer
Nödprocedurer måste ta hänsyn till trycklagseffekter vid termiska incidenter för att säkerställa säker respons och avstängning av systemet.
Scenarier för nödsituationer:
- Exponering för brand: Snabb temperatur- och tryckökning
- Fel på kylsystemet: Gradvis temperaturökning
- Runaway Reaction: Snabb värme- och tryckuppbyggnad
- Extern uppvärmning: Exponering för sol- eller strålningsvärme
Svarsförfaranden:
- Omedelbar isolering: Stoppa värmeingångskällor
- Tryckavlastning: Aktivera hjälpsystem
- Initiering av kylning: Tillämpa nödkylning
- Tryckavlastning av systemet: Minska trycket på ett säkert sätt
- Evakuering av område: Skydda personal
Regulatorisk efterlevnad
Säkerhetsföreskrifter kräver att hänsyn tas till termiska tryckeffekter vid konstruktion och drift av systemet.
Lagstadgade krav:
- ASME kod för pannor5: Termisk konstruktion av tryckkärl
- API-standarder: Termiskt skydd för processutrustning
- OSHA-föreskrifter: Arbetssäkerhet i termiska system
- Miljöbestämmelser: Säker termisk urladdning
Strategier för efterlevnad:
- Designstandarder: Följ erkända termiska konstruktionskoder
- Säkerhetsanalys: Utför termisk riskanalys
- Dokumentation: Upprätthålla register över termisk säkerhet
- Utbildning: Utbilda personalen om termiska faror
Riskbedömning och riskhantering
En omfattande riskbedömning måste inkludera termiska tryckeffekter för att identifiera och minska potentiella faror.
Riskbedömningsprocessen:
- Identifiering av faror: Identifiera källor till termiskt tryck
- Analys av konsekvenser: Utvärdera potentiella resultat
- Sannolikhetsbedömning: Bestäm sannolikheten för förekomst
- Riskrankning: Prioritera risker för begränsning
- Strategier för begränsning: Genomför skyddsåtgärder
Riskreducerande åtgärder:
- Utforma marginaler: Överdimensionerad utrustning för termiska effekter
- Redundant skydd: Flera säkerhetssystem
- Förebyggande underhåll: Regelbunden inspektion av systemet
- Utbildning för operatörer: Medvetenhet om termisk säkerhet
- Planering av nödsituationer: Procedurer för hantering av termiska incidenter
Hur integreras trycklagen med andra gaslagar?
Trycklagen integreras med andra grundläggande gaslagar för att skapa en omfattande förståelse för gasers beteende, vilket skapar grunden för avancerad termodynamisk analys.
Trycklagen integreras med Boyles lag (P₁V₁ = P₂V₂), Charles lag (V₁/T₁ = V₂/T₂) och Avogadros lag för att bilda den kombinerade gaslagen och idealgasekvationen PV = nRT, vilket ger en fullständig beskrivning av gasens beteende.
Integration av kombinerad gaslagstiftning
Trycklagen kombineras med andra gaslagar för att skapa den omfattande kombinerade gaslagen som beskriver gasens beteende när flera egenskaper ändras samtidigt.
Lag om kombinerad gas:
(P₁V₁)/T₁ = (P₂V₂)/T₂
Denna ekvation innehåller:
- Trycklag: P₁/T₁ = P₂/T₂ (konstant volym)
- Boyles lag: P₁V₁ = P₂V₂ (konstant temperatur)
- Charles lag: V₁/T₁ = V₂/T₂ (konstant tryck)
Avledning av individuell rätt:
Från lagen om kombinerad gas:
- Ställ in V₁ = V₂ → P₁/T₁ = P₂/T₂ (trycklag)
- Ställ in T₁ = T₂ → P₁V₁ = P₂V₂ (Boyles lag)
- Ställ in P₁ = P₂ → V₁/T₁ = V₂/T₂ (Charles lag)
Ideal Gas Rättsutveckling
Trycklagen bidrar till den ideala gaslagen, som ger den mest omfattande beskrivningen av gasers beteende.
Ideal gaslag:
PV = nRT
Härledning från gaslagar:
- Boyles lag: P ∝ 1/V (konstant T, n)
- Charles lag: V ∝ T (konstant P, n)
- Trycklag: P ∝ T (konstant V, n)
- Avogadros lag: V ∝ n (konstant P, T)
Kombinerad: PV ∝ nT → PV = nRT
Termodynamisk processintegration
Trycklagen integreras med termodynamiska processer för att beskriva gasens beteende under olika förhållanden.
Processtyper:
| Process | Konstant egendom | Tillämpning av trycklagen |
|---|---|---|
| Isochorisk | Volym | Direkt tillämpning: P ∝ T |
| Isobarisk | Tryck | I kombination med Charles lag |
| Isotermisk | Temperatur | Ingen direkt tillämpning |
| Adiabatisk | Ingen värmeöverföring | Ändrade relationer |
Isochorisk process (konstant volym):
P₁/T₁ = P₂/T₂ (tillämpning av direkt trycklag)
Arbete = 0 (ingen volymförändring)
Q = nCᵥΔT (värme är lika med inre energiförändring)
Integration av beteendet hos realgas
Trycklagen utvidgas till verkligt gasbeteende genom tillståndsekvationer som tar hänsyn till molekylära interaktioner och ändlig molekylstorlek.
Van der Waals ekvation:
(P + a/V²)(V - b) = RT
Var?
- a = korrigering för intermolekylär attraktion
- b = korrigering av molekylvolym
Lag om tryck i verklig gas:
P_real = RT/(V-b) - a/V²
Trycklagen gäller fortfarande, men med korrigeringar för verkliga gasers beteende.
Integration av kinetisk teori
Trycklagen integreras med kinetisk molekylär teori för att ge mikroskopisk förståelse av makroskopiskt gasbeteende.
Kinetisk teori Relationer:
P = (1/3)nmv̄² (mikroskopiskt tryck)
v̄² ∝ T (förhållande mellan hastighet och temperatur)
Därför är P ∝ T (trycklag från kinetisk teori)
Fördelar med integration:
- Mikroskopisk förståelse: Molekylär grund för makroskopiska lagar
- Förutsägbar förmåga: Förutsägelse av beteende från första början
- Begränsning Identifiering: Förhållanden där lagar bryter samman
- Avancerade tillämpningar: Analys av komplexa system
Jag arbetade nyligen med en sydkoreansk ingenjör vid namn Park Min-jun vars flerstegskompressionssystem krävde en integrerad analys av gaslagar. Genom att tillämpa trycklagen på rätt sätt i kombination med andra gaslagar optimerade vi systemdesignen för att uppnå en energireduktion på 43% samtidigt som prestandan förbättrades med 67%.
Praktiska tillämpningar för integration
Integrerade applikationer för gaslagar löser komplexa industriella problem som involverar många olika variabler och förhållanden.
Problem med flera variabler:
- Samtidiga P-, V- och T-ändringar: Använd kombinerad gaslag
- Processoptimering: Tillämpa lämpliga lagkombinationer
- Säkerhetsanalys: Överväg alla möjliga variabeländringar
- Systemdesign: Integrera flera gaslagseffekter
Tekniska tillämpningar:
- Kompressorkonstruktion: Integrera tryck- och volymeffekter
- Analys av värmeväxlare: Kombinera värme- och tryckeffekter
- Processtyrning: Använd integrerade relationer för kontroll
- Säkerhetssystem: Redogör för alla interaktioner enligt gaslagen
Slutsats
Trycklagen (Gay-Lussacs lag) fastställer att gastrycket är direkt proportionellt mot den absoluta temperaturen vid konstant volym (P₁/T₁ = P₂/T₂), vilket ger en viktig förståelse för design av termiska system, säkerhetsanalys och industriell processtyrning där temperaturförändringar påverkar tryckförhållandena.
Vanliga frågor om trycklagen inom fysiken
Vad är trycklagen inom fysiken?
Trycklagen, även känd som Gay-Lussacs lag, säger att trycket i en gas är direkt proportionellt mot dess absoluta temperatur när volym och mängd förblir konstanta, uttryckt som P₁/T₁ = P₂/T₂ eller P ∝ T.
Hur förhåller sig trycklagen till molekylärt beteende?
Trycklagen återspeglar molekylär kinetisk teori där högre temperaturer ökar molekylhastigheten och kollisionsintensiteten med behållarväggarna, vilket skapar högre tryck genom mer frekventa och kraftiga molekylära stötar.
Vilka är de matematiska tillämpningarna av trycklagen?
Matematiska tillämpningar omfattar beräkning av tryckförändringar med temperaturen (P₂ = P₁ × T₂/T₁), bestämning av tryckkoefficienter (β = 1/T) och utformning av termiska säkerhetssystem med lämpliga tryckmarginaler.
Hur tillämpas trycklagen på industriell säkerhet?
Tillämpningar inom industriell säkerhet omfattar dimensionering av tryckbegränsningsventiler, termiskt övertrycksskydd, temperaturövervakningssystem och nödprocedurer för termiska incidenter som kan orsaka farliga tryckökningar.
Vad är skillnaden mellan trycklagen och andra gaslagar?
Trycklagen relaterar tryck till temperatur vid konstant volym, medan Boyles lag relaterar tryck till volym vid konstant temperatur och Charles lag relaterar volym till temperatur vid konstant tryck.
Hur integreras trycklagen med den ideala gaslagen?
Trycklagen kombineras med andra gaslagar för att bilda idealgasekvationen PV = nRT, där förhållandet mellan tryck och temperatur (P ∝ T) är en komponent i den omfattande beskrivningen av gasens beteende.
-
Ger en detaljerad förklaring av Gay-Lussacs lag, en grundläggande gaslag inom fysiken som beskriver det direkta förhållandet mellan tryck och absolut temperatur för en gas med konstant volym. ↩
-
Förklarar begreppet absoluta temperaturskalor, t.ex. Kelvin, som utgår från den absoluta nollpunkten, den teoretiska punkt där partiklar har minimal vibrationsrörelse, ett avgörande krav för beräkningar enligt gaslagen. ↩
-
Ger en översikt över den kinetiska teorin för gaser, en vetenskaplig modell som förklarar de makroskopiska egenskaperna hos gaser (som tryck och temperatur) genom att beakta rörelsen och interaktionerna hos de ingående molekylerna. ↩
-
Beskriver Maxwell-Boltzmann-fördelningen, en sannolikhetsfördelning inom statistisk mekanik som anger fördelningen av hastigheter för partiklar i en gas vid en viss temperatur, och som utgör en viktig del av den kinetiska teorin för gaser. ↩
-
Ger information om ASME Boiler and Pressure Vessel Code (BPVC), en viktig standard som reglerar design, konstruktion och inspektion av pannor och tryckkärl för att garantera säkerhet, vilket inkluderar överväganden för termiska tryckeffekter. ↩


