Les malentendus concernant les lois de la pression sont à l'origine de plus de $25 milliards d'euros de défaillances industrielles chaque année, en raison de calculs thermiques et de conceptions de systèmes de sécurité incorrects. Les ingénieurs confondent souvent les lois sur la pression avec d'autres lois sur les gaz, ce qui entraîne des pannes d'équipement catastrophiques et des inefficacités énergétiques. La compréhension de la loi de pression permet d'éviter des erreurs coûteuses et de concevoir des systèmes thermiques optimaux.
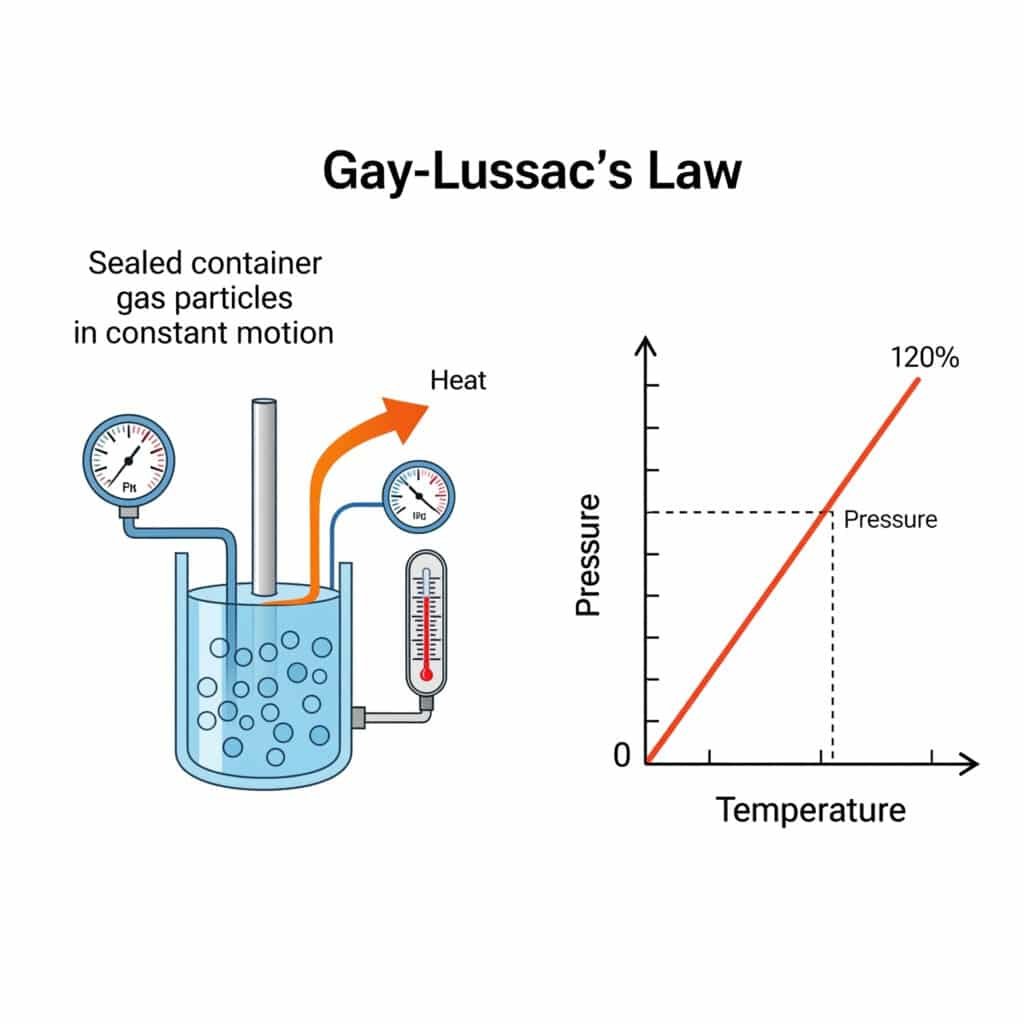
En physique, la loi de la pression est la suivante Loi de Gay-Lussac1La pression d'un gaz est directement proportionnelle à son volume. température absolue2 lorsque le volume et la quantité restent constants, exprimée mathématiquement par P₁/T₁ = P₂/T₂, régissant les effets de pression thermique dans les systèmes industriels.
Il y a trois mois, j'ai conseillé une ingénieure chimiste française, Marie Dubois, dont le système de cuves sous pression connaissait des pics de pression dangereux pendant les cycles de chauffage. Son équipe utilisait des calculs de pression simplifiés sans appliquer correctement la loi de pression. Après avoir mis en œuvre les calculs corrects de la loi de pression et la compensation thermique, nous avons éliminé les incidents de sécurité liés à la pression et amélioré la fiabilité du système de 78% tout en réduisant la consommation d'énergie de 32%.
Table des matières
- Qu'est-ce que la loi de Gay-Lussac sur la pression et ses principes fondamentaux ?
- Quel est le lien entre la loi de pression et la physique moléculaire ?
- Quelles sont les applications mathématiques de la loi de pression ?
- Comment la loi de la pression s'applique-t-elle aux systèmes thermiques industriels ?
- Quelles sont les implications de la loi sur la pression en matière de sécurité ?
- Comment la loi de la pression s'intègre-t-elle aux autres lois sur les gaz ?
- Conclusion
- FAQ sur la loi de la pression en physique
Qu'est-ce que la loi de Gay-Lussac sur la pression et ses principes fondamentaux ?
La loi de Gay-Lussac, également connue sous le nom de loi de pression, établit la relation fondamentale entre la pression et la température des gaz à volume constant, constituant ainsi une pierre angulaire de la thermodynamique et de la physique des gaz.
La loi de Gay-Lussac sur la pression stipule que la pression d'une quantité fixe de gaz à volume constant est directement proportionnelle à sa température absolue, exprimée mathématiquement par P₁/T₁ = P₂/T₂, ce qui permet de prédire les changements de pression en fonction des variations de température.
Développement historique et découverte
La loi de Gay-Lussac sur la pression a été découverte par le chimiste français Joseph Louis Gay-Lussac en 1802, en s'appuyant sur les travaux antérieurs de Jacques Charles et en fournissant des informations cruciales sur le comportement des gaz.
Chronologie historique :
| Année | Scientifique | Contribution |
|---|---|---|
| 1787 | Jacques Charles | Observations initiales température-volume |
| 1802 | Gay-Lussac | Formulation de la loi pression-température |
| 1834 | Émile Clapeyron | Combinaison des lois sur les gaz en une équation idéale des gaz |
| 1857 | Rudolf Clausius | Théorie cinétique3 explication |
Importance scientifique :
- Relations quantitatives: Première description mathématique précise du comportement pression-température
- Température absolue: Démonstration de l'importance de l'échelle de température absolue
- Comportement universel: S'applique à tous les gaz dans des conditions idéales
- Fondation thermodynamique: A contribué au développement de la thermodynamique
Énoncé fondamental de la loi de la pression
La loi de pression établit une relation proportionnelle directe entre la pression et la température absolue dans des conditions spécifiques.
Déclaration formelle :
"La pression d'une quantité fixe de gaz à volume constant est directement proportionnelle à sa température absolue.
Expression mathématique :
P ∝ T (à volume et quantité constants)
P₁/T₁ = P₂/T₂ (forme comparative)
P = kT (où k est une constante)
Conditions requises :
- Volume constant: Le volume du conteneur reste inchangé
- Montant constant: Le nombre de molécules de gaz reste fixe
- Comportement des gaz idéaux: Suppose des conditions de gaz idéal
- Température absolue: Température mesurée en Kelvin ou Rankine
Interprétation physique
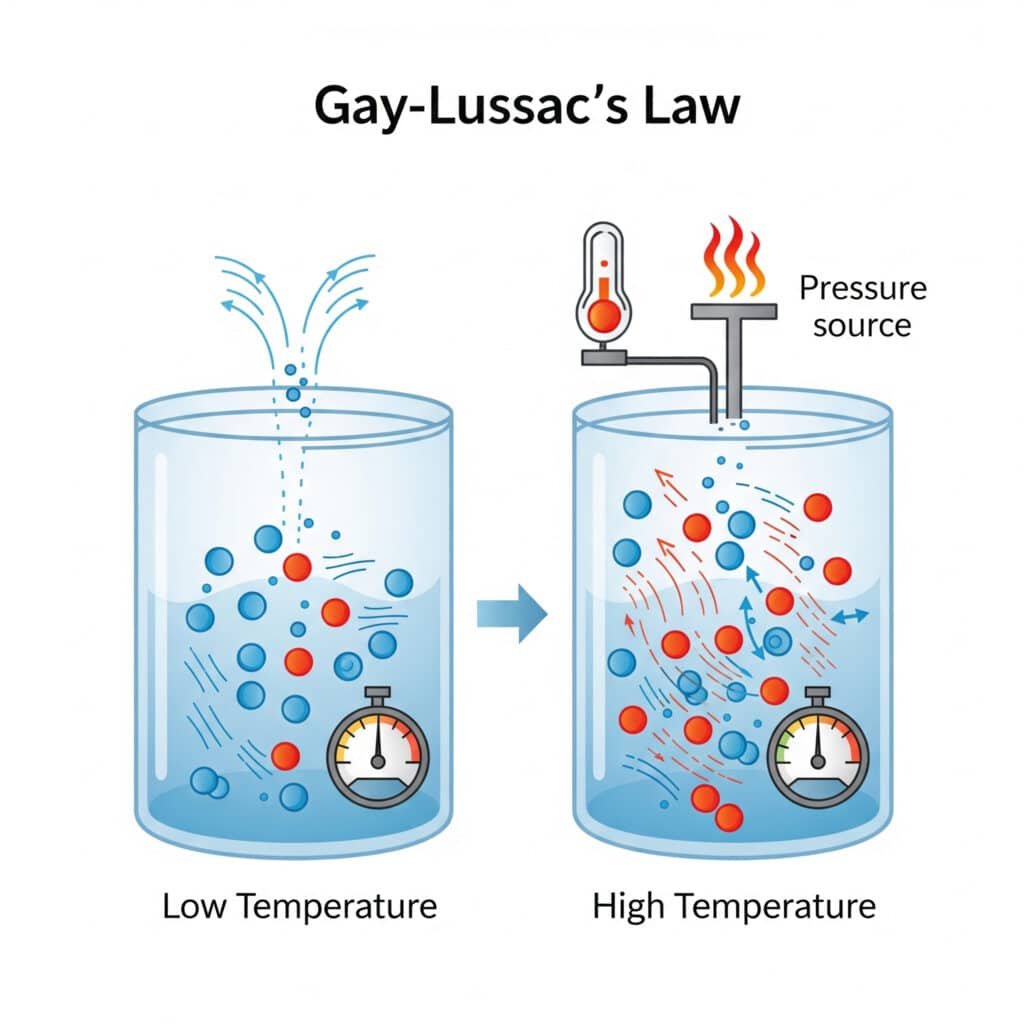
La loi de pression reflète le comportement moléculaire fondamental où les changements de température affectent directement le mouvement moléculaire et l'intensité des collisions.
Explication moléculaire :
- Température plus élevée: Augmentation de l'énergie cinétique moléculaire
- Mouvement moléculaire plus rapide: Collisions à plus grande vitesse avec les parois du conteneur
- Augmentation de la force de collision: Des impacts moléculaires plus intenses
- Pression plus élevée: Plus grande force par unité de surface sur les parois du conteneur
Proportionnalité Constante :
k = P/T = nR/V
Où ?
- n = Nombre de moles
- R = Constante universelle des gaz
- V = Volume
Implications pratiques
La loi de pression a des implications pratiques importantes pour les systèmes industriels impliquant des changements de température dans des gaz confinés.
Applications clés :
- Conception d'appareils à pression: Tenir compte des augmentations de pression thermique
- Conception des systèmes de sécurité: Prévenir les surpressions dues à l'échauffement
- Contrôle des processus: Prévoir les variations de pression en fonction de la température
- Calculs énergétiques: Déterminer les effets de l'énergie thermique
Considérations relatives à la conception :
| Changement de température | Effet de pression | Implications en matière de sécurité |
|---|---|---|
| +100°C (373K à 473K) | +27% augmentation de la pression | Nécessite une décharge de pression |
| +200°C (373K à 573K) | +54% augmentation de la pression | Préoccupation critique en matière de sécurité |
| -50°C (373K à 323K) | -13% diminution de la pression | Formation potentielle de vide |
| -100°C (373K à 273K) | -27% diminution de la pression | Considérations structurelles |
Quel est le lien entre la loi de pression et la physique moléculaire ?
La loi de pression émerge des principes de la physique moléculaire, où les changements induits par la température dans le mouvement moléculaire affectent directement la génération de pression par le biais de la modification de la dynamique des collisions.
La loi de la pression reflète la théorie cinétique moléculaire où les augmentations de température accroissent la vitesse moléculaire moyenne, entraînant des collisions plus fréquentes et plus intenses avec les parois, ce qui génère une pression plus élevée selon P = (1/3)nmv̄², reliant le mouvement microscopique à la pression macroscopique.
Fondation de la théorie cinétique
La théorie cinétique moléculaire fournit l'explication microscopique de la loi de pression à travers la relation entre la température et le mouvement moléculaire.
Relation entre l'énergie cinétique et la température :
Énergie cinétique moyenne = (3/2)kT
Où ?
- k = constante de Boltzmann (1,38 × 10-²³ J/K)
- T = Température absolue
Relation entre la vitesse moléculaire et la température :
v_rms = √(3kT/m) = √(3RT/M)
Où ?
- v_rms = Vitesse quadratique moyenne
- m = Masse moléculaire
- R = Constante du gaz
- M = Masse molaire
Mécanisme de génération de pression
La pression résulte des collisions moléculaires avec les parois du récipient, l'intensité des collisions étant directement liée à la vitesse moléculaire et à la température.
Pression basée sur les collisions :
P = (1/3) × n × m × v̄²
Où ?
- n = Densité du nombre de molécules
- m = Masse moléculaire
- v̄² = Vitesse quadratique moyenne
Effet de la température sur la pression :
Puisque v̄² ∝ T, alors P ∝ T (à volume et quantité constants)
Analyse de la fréquence des collisions :
| Température | Vitesse moléculaire | Fréquence des collisions | Effet de pression |
|---|---|---|---|
| 273 K | 461 m/s (air) | 7.0 × 10⁹ s-¹ | Base de référence |
| 373 K | 540 m/s (air) | 8.2 × 10⁹ s-¹ | +37% pression |
| 573 K | 668 m/s (air) | 10.1 × 10⁹ s-¹ | +110% pression |
Effets de la distribution de Maxwell-Boltzmann
Les changements de température modifient la Maxwell-Boltzmann4 la distribution des vitesses, ce qui affecte l'énergie moyenne de la collision et la pression générée.
Fonction de distribution de la vitesse :
f(v) = 4π(m/2πkT)^(3/2) × v² × e^(-mv²/2kT)
Effets de la température sur la distribution :
- Température plus élevée: Distribution plus large, vitesse moyenne plus élevée
- Température inférieure: Distribution plus étroite, vitesse moyenne plus faible
- Changement de distribution: La vitesse maximale augmente avec la température
- Extension de la queue: Plus de molécules à grande vitesse à des températures plus élevées
Dynamique des collisions moléculaires
La loi de pression reflète les changements dans la dynamique des collisions moléculaires lorsque la température varie, affectant à la fois la fréquence et l'intensité des collisions.
Paramètres de collision :
Taux de collision = (n × v̄)/4 (par unité de surface et par seconde)
Force moyenne de collision = m × Δv
Pression = taux de collision × force moyenne
Impact de la température :
- Fréquence des collisions: Augmente avec √T
- Intensité de la collision: Augmente avec T
- Effet combiné: La pression augmente linéairement avec T
- Contrainte de paroi: Une température plus élevée crée une plus grande contrainte sur les parois
J'ai récemment travaillé avec un ingénieur japonais, Hiroshi Tanaka, dont le système de réacteur à haute température présentait un comportement inattendu en matière de pression. En appliquant les principes de la physique moléculaire pour comprendre la loi de la pression à des températures élevées, nous avons amélioré la précision de la prédiction de la pression de 89% et éliminé les pannes d'équipement liées à la température.
Quelles sont les applications mathématiques de la loi de pression ?
La loi de pression fournit des relations mathématiques essentielles pour calculer les variations de pression en fonction de la température, ce qui permet une conception précise des systèmes et des prévisions de fonctionnement.
Les applications mathématiques de la loi de pression comprennent les calculs de proportionnalité directe P₁/T₁ = P₂/T₂, les formules de prédiction de la pression, les corrections de dilatation thermique et l'intégration avec les équations thermodynamiques pour une analyse complète du système.
Calculs de base de la loi de pression
La relation mathématique fondamentale permet de calculer directement les variations de pression en fonction des variations de température.
Equation primaire :
P₁/T₁ = P₂/T₂
Formes réarrangées :
- P₂ = P₁ × (T₂/T₁) (calculer la pression finale)
- T₂ = T₁ × (P₂/P₁) (calculer la température finale)
- P₁ = P₂ × (T₁/T₂) (calculer la pression initiale)
Exemple de calcul :
Conditions initiales : P₁ = 100 PSI, T₁ = 293 K (20°C)
Température finale : T₂ = 373 K (100°C)
Pression finale : P₂ = 100 × (373/293) = 127,3 PSI
Calculs du coefficient de pression
Le coefficient de pression quantifie le taux de variation de la pression en fonction de la température, ce qui est essentiel pour la conception des systèmes thermiques.
Définition du coefficient de pression :
β = (1/P) × (∂P/∂T)_V = 1/T
Pour les gaz idéaux : β = 1/T (à volume constant)
Applications du coefficient de pression :
| Température (K) | Coefficient de pression (K-¹) | Variation de la pression par °C |
|---|---|---|
| 273 | 0.00366 | 0,366% par °C |
| 293 | 0.00341 | 0,341% par °C |
| 373 | 0.00268 | 0,268% par °C |
| 573 | 0.00175 | 0,175% par °C |
Calculs de la pression de dilatation thermique
Lorsque des gaz sont chauffés dans des espaces confinés, la loi de pression calcule les augmentations de pression qui en résultent à des fins de sécurité et de conception.
Chauffage au gaz en milieu confiné :
ΔP = P₁ × (ΔT/T₁)
Où ΔT est le changement de température.
Calculs du facteur de sécurité :
Pression de conception = Pression de fonctionnement × (T_max/T_fonctionnement) × Facteur de sécurité
Exemple de calcul de sécurité :
Conditions de fonctionnement : 100 PSI à 20°C (293 K)
Température maximale : 150°C (423 K)
Facteur de sécurité : 1,5
Pression de conception : 100 × (423/293) × 1,5 = 216,5 PSI
Représentations graphiques
La loi de pression crée des relations linéaires lorsqu'elle est correctement tracée, ce qui permet l'analyse graphique et l'extrapolation.
Relation linéaire :
P vs. T (température absolue) : Ligne droite passant par l'origine
Pente = P/T = constante
Applications graphiques :
- Analyse des tendances: Identifier les écarts par rapport au comportement idéal
- Extrapolation: Prévoir le comportement dans des conditions extrêmes
- Validation des données: Vérifier les résultats expérimentaux
- Optimisation du système: Identifier les conditions optimales de fonctionnement
Intégration des équations thermodynamiques
La loi de pression s'intègre à d'autres relations thermodynamiques pour une analyse complète du système.
Combiné à la loi des gaz idéaux :
PV = nRT combinée avec P ∝ T donne une description complète du comportement des gaz
Calculs du travail thermodynamique :
Travail = ∫P dV (pour les changements de volume)
Travail = nR ∫T dV/V (incorporation de la loi de la pression)
Relations de transfert de chaleur :
Q = nCᵥΔT (chauffage à volume constant)
ΔP = (nR/V) × ΔT (augmentation de la pression due au chauffage)
Comment la loi de la pression s'applique-t-elle aux systèmes thermiques industriels ?
La loi de pression régit les applications industrielles critiques impliquant des changements de température dans des systèmes gazeux confinés, des réservoirs sous pression aux équipements de traitement thermique.
Les applications industrielles de la loi de pression comprennent la conception de réservoirs sous pression, les systèmes de sécurité thermique, les calculs de chauffage de processus et la compensation de température dans les systèmes pneumatiques, où P₁/T₁ = P₂/T₂ détermine les réponses de la pression aux changements thermiques.
Applications de la conception des appareils à pression
La loi de pression est fondamentale pour la conception des appareils à pression, car elle garantit un fonctionnement sûr dans des conditions de température variables.
Calculs de la pression de conception :
Pression de conception = Pression de fonctionnement maximale × (T_max/T_fonctionnement)
Analyse des contraintes thermiques :
Lorsque le gaz est chauffé dans un récipient rigide :
- Augmentation de la pression: P₂ = P₁ × (T₂/T₁)
- Contrainte de paroi: σ = P × r/t (approximation des parois minces)
- Marge de sécurité: Tenir compte des effets de la dilatation thermique
Exemple de conception :
Réservoir de stockage : 1000 L à 100 PSI, 20°C
Température de service maximale : 80°C
Rapport de température : (80+273,15)/(20+273,15) = 353,15/293,15 = 1,205
Pression de conception : 100 × 1,205 × 1,5 (facteur de sécurité) = 180,7 PSI
Systèmes de traitement thermique
Les systèmes industriels de traitement thermique s'appuient sur la loi de pression pour contrôler et prévoir les variations de pression pendant les cycles de chauffage et de refroidissement.
Applications de processus :
| Type de processus | Plage de température | Application de la loi sur la pression |
|---|---|---|
| Traitement thermique | 200-1000°C | Contrôle de la pression atmosphérique du four |
| Réacteurs chimiques | 100-500°C | Gestion de la pression de réaction |
| Systèmes de séchage | 50-200°C | Calculs de la pression de vapeur |
| Stérilisation | 120-150°C | Relations avec la pression de la vapeur |
Calculs de contrôle des processus :
Point de consigne de la pression = pression de base × (température du processus/température de base)
Compensation de la température du système pneumatique
Les systèmes pneumatiques nécessitent une compensation de température pour maintenir des performances constantes dans des conditions environnementales variables.
Formule de compensation de la température :
P_compensée = P_standard × (T_actuelle/T_standard)
Demandes d'indemnisation :
- Force de l'actionneur: Maintien d'une force constante
- Contrôle du débit: Compenser les variations de densité
- Régulation de la pression: Ajuster les points de consigne pour la température
- Étalonnage du système: Tenir compte des effets thermiques
Exemple de rémunération :
Conditions standard : 100 PSI à 20°C (293,15 K)
Température de fonctionnement : 50°C (323.15 K)
Pression compensée : 100 × (323,15/293,15) = 110,2 PSI
Conception des systèmes de sécurité
La loi de pression est essentielle pour concevoir des systèmes de sécurité qui protègent contre les conditions de surpression thermique.
Dimensionnement des soupapes de sûreté :
Pression de décharge = Pression de fonctionnement × (T_max/T_fonctionnement) × Facteur de sécurité
Composants du système de sécurité :
- Soupapes de sûreté: Prévenir les surpressions dues à l'échauffement
- Contrôle de la température: Conditions thermiques de la piste
- Pressostats: Alarme en cas de pression excessive
- Isolation thermique: Contrôle de l'exposition à la température
Applications des échangeurs de chaleur
Les échangeurs de chaleur utilisent la loi de pression pour prévoir et contrôler les changements de pression lorsque les gaz sont chauffés ou refroidis.
Calculs de la pression des échangeurs de chaleur :
ΔP_thermal = P_inlet × (T_outlet - T_inlet)/T_inlet
Considérations relatives à la conception :
- Chute de pression: Tenir compte des effets de friction et des effets thermiques
- Joints de dilatation: Adaptation à la dilatation thermique
- Pression nominale: Conception pour une pression thermique maximale
- Systèmes de contrôle: Maintenir des conditions de pression optimales
J'ai récemment travaillé avec un ingénieur en procédés allemand, Klaus Weber, dont le système de traitement thermique connaissait des problèmes de contrôle de la pression. En appliquant correctement la loi de pression et en mettant en œuvre un contrôle de pression compensé par la température, nous avons amélioré la stabilité du processus de 73% et réduit les pannes d'équipement liées à la température de 85%.
Quelles sont les implications de la loi sur la pression en matière de sécurité ?
La loi de pression a des implications critiques en matière de sécurité dans les systèmes industriels, où les augmentations de température peuvent créer des conditions de pression dangereuses qui doivent être anticipées et contrôlées.
Les implications de la loi de pression en matière de sécurité comprennent la protection contre les surpressions thermiques, la conception des systèmes de décharge de pression, les exigences en matière de surveillance de la température et les procédures d'urgence en cas d'incidents thermiques, où un échauffement incontrôlé peut provoquer des augmentations de pression catastrophiques selon P₂ = P₁ × (T₂/T₁).
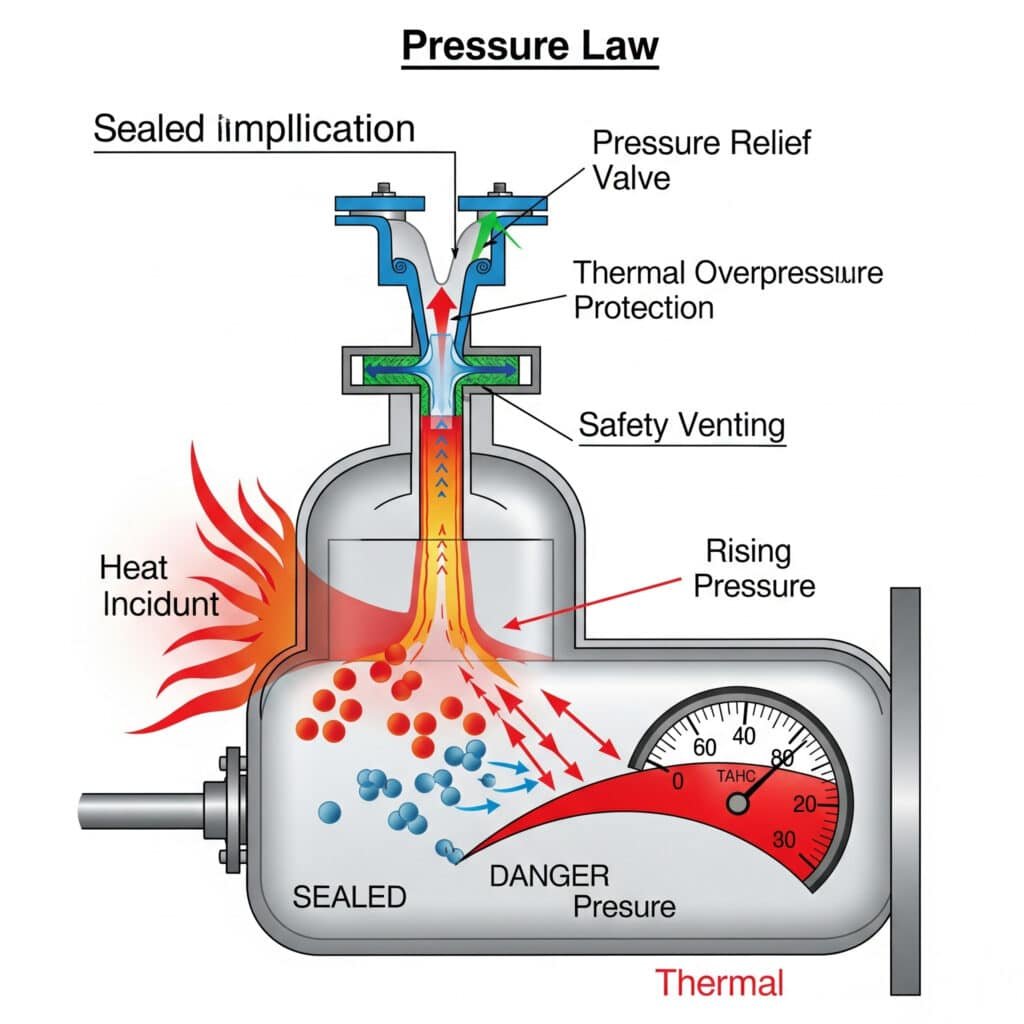
Risques de surpression thermique
Les augmentations de température non contrôlées peuvent créer des conditions de pression dangereuses qui dépassent les limites de conception de l'équipement et créent des risques pour la sécurité.
Scénarios de surpression :
| Scénario | Augmentation de la température | Augmentation de la pression | Niveau de danger |
|---|---|---|---|
| Exposition au feu | +500°C (293K à 793K) | +171% | Catastrophique |
| Processus perturbé | +100°C (293K à 393K) | +34% | Sévère |
| Chauffage solaire | +50°C (293K à 343K) | +17% | Modéré |
| Dysfonctionnement de l'équipement | +200°C (293K à 493K) | +68% | Critique |
Modes de défaillance :
- Rupture du vaisseau: Défaillance catastrophique due à une surpression
- Défaillance du joint: Détérioration du joint et de la garniture sous l'effet de la pression/température
- Défaillance de la tuyauterie: Rupture de ligne sous l'effet d'une contrainte thermique
- Dommages aux composants: Défaillance de l'équipement due à un cycle thermique
Conception du système de décharge de pression
Les systèmes de décompression doivent tenir compte des augmentations de pression thermique afin d'assurer une protection adéquate contre les surpressions.
Dimensionnement de la soupape de décharge :
Capacité de décharge = Pression thermique maximale × Facteur de débit
Calculs de décharge thermique :
P_relief = P_operating × (T_max/T_operating) × 1.1 (marge 10%)
Composants du système de décharge :
- Secours primaire: Soupape de décharge de la pression principale
- Secours secondaire: Système de protection de secours
- Disques de rupture: Protection ultime contre les surpressions
- Soulagement thermique: Protection spécifique contre la dilatation thermique
Surveillance et contrôle de la température
Une surveillance efficace de la température permet d'éviter les augmentations de pression dangereuses en détectant les conditions thermiques avant qu'elles ne deviennent dangereuses.
Exigences en matière de surveillance :
- Capteurs de température: Mesure continue de la température
- Capteurs de pression: Surveiller l'augmentation de la pression
- Systèmes d'alarme: Alerter les opérateurs en cas de conditions dangereuses
- Arrêt automatique: Isolation du système d'urgence
Stratégies de contrôle :
| Méthode de contrôle | Temps de réponse | Efficacité | Applications |
|---|---|---|---|
| Alarmes de température | Secondes | Haut | Alerte précoce |
| Blocages de pression | Millisecondes | Très élevé | Arrêt d'urgence |
| Systèmes de refroidissement | Procès-verbal | Modéré | Contrôle de la température |
| Vannes d'isolement | Secondes | Haut | Isolation du système |
Procédures d'intervention en cas d'urgence
Les procédures d'urgence doivent tenir compte des effets de la loi de pression lors d'incidents thermiques afin de garantir la sécurité de l'intervention et de l'arrêt du système.
Scénarios d'urgence :
- Exposition au feu: Augmentation rapide de la température et de la pression
- Défaillance du système de refroidissement: Augmentation progressive de la température
- Réaction d'emballement: Augmentation rapide de la température et de la pression
- Chauffage externe: Exposition à la chaleur solaire ou radiante
Procédures de réponse :
- Isolement immédiat: Arrêter les sources de chaleur
- Décharge de pression: Activer les systèmes de secours
- Initiation du refroidissement: Appliquer le refroidissement d'urgence
- Dépressurisation du système: Réduire la pression en toute sécurité
- Évacuation de la zone: Protéger le personnel
Conformité réglementaire
Les réglementations en matière de sécurité exigent la prise en compte des effets de la pression thermique dans la conception et le fonctionnement des systèmes.
Exigences réglementaires :
- Code ASME des chaudières5: Conception thermique des appareils à pression
- Normes API: Protection thermique des équipements de process
- Réglementation OSHA: Sécurité des travailleurs dans les systèmes thermiques
- Réglementations environnementales: Décharge thermique sûre
Stratégies de conformité :
- Normes de conception: Respecter les codes de conception thermique reconnus
- Analyse de la sécurité: Effectuer une analyse des risques thermiques
- Documentation: Tenir à jour les registres de sécurité thermique
- Formation: Sensibiliser le personnel aux risques thermiques
Évaluation et gestion des risques
Une évaluation complète des risques doit inclure les effets de la pression thermique afin d'identifier et d'atténuer les dangers potentiels.
Processus d'évaluation des risques :
- Identification des risques: Identifier les sources de pression thermique
- Analyse des conséquences: Évaluer les résultats potentiels
- Évaluation des probabilités: Déterminer la probabilité d'occurrence
- Classement des risques: Classer les risques par ordre de priorité pour les atténuer
- Stratégies d'atténuation: Mettre en œuvre des mesures de protection
Mesures d'atténuation des risques :
- Marges de conception: Equipement surdimensionné pour les effets thermiques
- Protection redondante: Systèmes de sécurité multiples
- Maintenance préventive: Inspection régulière du système
- Formation des opérateurs: Sensibilisation à la sécurité thermique
- Planification d'urgence: Procédures de réponse aux incidents thermiques
Comment la loi de la pression s'intègre-t-elle aux autres lois sur les gaz ?
La loi de pression s'intègre à d'autres lois fondamentales sur les gaz pour former une compréhension globale du comportement des gaz, créant ainsi la base d'une analyse thermodynamique avancée.
La loi de pression s'intègre à la loi de Boyle (P₁V₁ = P₂V₂), à la loi de Charles (V₁/T₁ = V₂/T₂) et à la loi d'Avogadro pour former la loi combinée des gaz et l'équation des gaz idéaux PV = nRT, fournissant ainsi une description complète du comportement des gaz.
Intégration de la loi sur les gaz combinés
La loi de pression se combine avec d'autres lois sur les gaz pour créer la loi globale sur les gaz combinés qui décrit le comportement des gaz lorsque plusieurs propriétés changent simultanément.
Loi sur les gaz combinés :
(P₁V₁)/T₁ = (P₂V₂)/T₂
Cette équation intègre :
- Loi sur la pression: P₁/T₁ = P₂/T₂ (volume constant)
- Loi de Boyle: P₁V₁ = P₂V₂ (température constante)
- La loi de Charles: V₁/T₁ = V₂/T₂ (pression constante)
Dérivation du droit individuel :
D'après la loi des gaz combinés :
- Régler V₁ = V₂ → P₁/T₁ = P₂/T₂ (loi de la pression)
- Ensemble T₁ = T₂ → P₁V₁ = P₂V₂ (loi de Boyle)
- Fixer P₁ = P₂ → V₁/T₁ = V₂/T₂ (loi de Charles)
Développement de la loi sur les gaz idéaux
La loi de pression contribue à la loi des gaz idéaux, qui fournit la description la plus complète du comportement des gaz.
Loi des gaz idéaux :
PV = nRT
Dérivation à partir des lois sur les gaz :
- Loi de Boyle: P ∝ 1/V (constante T, n)
- La loi de Charles: V ∝ T (constante P, n)
- Loi sur la pression: P ∝ T (V constant, n)
- Loi d'Avogadro: V ∝ n (constante P, T)
Combinés : PV ∝ nT → PV = nRT
Intégration des processus thermodynamiques
La loi de pression s'intègre aux processus thermodynamiques pour décrire le comportement des gaz dans différentes conditions.
Types de processus :
| Processus | Propriété constante | Application de la loi sur la pression |
|---|---|---|
| Isochorique | Volume | Application directe : P ∝ T |
| Isobarique | Pression | Combinée à la loi de Charles |
| Isotherme | Température | Pas d'application directe |
| Adiabatique | Pas de transfert de chaleur | Relations modifiées |
Processus isochorique (volume constant) :
P₁/T₁ = P₂/T₂ (application directe de la loi sur la pression)
Travail = 0 (pas de changement de volume)
Q = nCᵥΔT (la chaleur équivaut à un changement d'énergie interne)
Intégration du comportement des gaz réels
La loi de pression s'étend au comportement réel des gaz par le biais d'équations d'état qui tiennent compte des interactions moléculaires et de la taille finie des molécules.
Équation de Van der Waals :
(P + a/V²)(V - b) = RT
Où ?
- a = Correction de l'attraction intermoléculaire
- b = Correction du volume moléculaire
Loi sur la pression des gaz réels :
P_real = RT/(V-b) - a/V²
La loi de la pression s'applique toujours, mais avec des corrections pour tenir compte du comportement réel des gaz.
Intégration de la théorie cinétique
La loi de pression s'intègre à la théorie cinétique moléculaire pour fournir une compréhension microscopique du comportement macroscopique des gaz.
Relations de la théorie cinétique :
P = (1/3)nmv̄² (pression microscopique)
v̄² ∝ T (relation vitesse-température)
Par conséquent : P ∝ T (loi de pression de la théorie cinétique)
Avantages de l'intégration :
- Compréhension microscopique: Base moléculaire des lois macroscopiques
- Capacité de prévision: Prédiction du comportement à partir de principes premiers
- Identification des limites: Conditions dans lesquelles les lois ne sont pas respectées
- Applications avancées: Analyse des systèmes complexes
J'ai récemment travaillé avec un ingénieur sud-coréen, Park Min-jun, dont le système de compression à plusieurs étages nécessitait une analyse intégrée des lois sur les gaz. En appliquant correctement la loi de pression en combinaison avec d'autres lois sur les gaz, nous avons optimisé la conception du système pour obtenir une réduction d'énergie de 43% tout en améliorant les performances de 67%.
Applications pratiques d'intégration
Les applications intégrées de la loi sur les gaz permettent de résoudre des problèmes industriels complexes qui impliquent de multiples variables et conditions changeantes.
Problèmes à variables multiples :
- Changements simultanés de P, V, T: Utiliser la loi des gaz combinés
- Optimisation des processus: Appliquer les combinaisons de lois appropriées
- Analyse de la sécurité: Envisager tous les changements de variables possibles
- Conception du système: Intégrer les effets multiples de la loi des gaz
Applications d'ingénierie :
- Conception du compresseur: Intégrer les effets de pression et de volume
- Analyse des échangeurs de chaleur: Combiner les effets thermiques et de pression
- Contrôle des processus: Utiliser des relations intégrées pour le contrôle
- Systèmes de sécurité: Prise en compte de toutes les interactions de la loi des gaz
Conclusion
La loi de pression (loi de Gay-Lussac) établit que la pression des gaz est directement proportionnelle à la température absolue à volume constant (P₁/T₁ = P₂/T₂), fournissant une compréhension essentielle pour la conception des systèmes thermiques, l'analyse de la sécurité et le contrôle des processus industriels où les changements de température affectent les conditions de pression.
FAQ sur la loi de la pression en physique
Qu'est-ce que la loi de la pression en physique ?
La loi de pression, également connue sous le nom de loi de Gay-Lussac, stipule que la pression d'un gaz est directement proportionnelle à sa température absolue lorsque le volume et la quantité restent constants, ce qui s'exprime par P₁/T₁ = P₂/T₂ ou P ∝ T.
Quelle est la relation entre la loi de pression et le comportement moléculaire ?
La loi sur la pression reflète la théorie cinétique moléculaire selon laquelle des températures plus élevées augmentent la vitesse moléculaire et l'intensité des collisions avec les parois des conteneurs, créant ainsi une pression plus élevée grâce à des impacts moléculaires plus fréquents et plus forts.
Quelles sont les applications mathématiques de la loi de pression ?
Les applications mathématiques comprennent le calcul des variations de pression en fonction de la température (P₂ = P₁ × T₂/T₁), la détermination des coefficients de pression (β = 1/T) et la conception de systèmes de sécurité thermique avec des marges de pression adéquates.
Comment la loi sur les pressions s'applique-t-elle à la sécurité industrielle ?
Les applications de sécurité industrielle comprennent le dimensionnement des soupapes de sûreté, la protection contre les surpressions thermiques, les systèmes de surveillance de la température et les procédures d'urgence en cas d'incidents thermiques susceptibles de provoquer des augmentations de pression dangereuses.
Quelle est la différence entre la loi de pression et les autres lois sur les gaz ?
La loi de pression relie la pression à la température à volume constant, tandis que la loi de Boyle relie la pression au volume à température constante et la loi de Charles relie le volume à la température à pression constante.
Comment la loi de la pression s'intègre-t-elle à la loi des gaz idéaux ?
La loi de la pression se combine à d'autres lois sur les gaz pour former l'équation du gaz idéal PV = nRT, où la relation pression-température (P ∝ T) est l'un des éléments de la description complète du comportement des gaz.
-
Explique en détail la loi de Gay-Lussac, une loi fondamentale de la physique des gaz qui décrit la relation directe entre la pression et la température absolue d'un gaz à volume constant. ↩
-
Explique le concept des échelles de température absolue, comme le Kelvin, qui partent du zéro absolu, le point théorique où les particules ont un mouvement vibratoire minimal, une exigence cruciale pour les calculs de la loi des gaz. ↩
-
Offre une vue d'ensemble de la théorie cinétique des gaz, un modèle scientifique qui explique les propriétés macroscopiques des gaz (comme la pression et la température) en tenant compte du mouvement et des interactions de leurs molécules constitutives. ↩
-
Décrit la distribution de Maxwell-Boltzmann, une distribution de probabilité en mécanique statistique qui spécifie la distribution des vitesses des particules dans un gaz à une certaine température, constituant un élément clé de la théorie cinétique des gaz. ↩
-
Fournit des informations sur le code ASME des chaudières et appareils à pression (BPVC), une norme majeure qui réglemente la conception, la construction et l'inspection des chaudières et des appareils à pression afin de garantir la sécurité, ce qui inclut la prise en compte des effets de la pression thermique. ↩


