
Misvattingen over gassen veroorzaken jaarlijks miljarden aan industriële verliezen. Ingenieurs behandelen gassen vaak als vloeistoffen of vaste stoffen, wat leidt tot catastrofale systeemfouten en veiligheidsrisico's. Inzicht in fundamentele gasconcepten voorkomt kostbare fouten en optimaliseert de systeemprestaties.
Gas is een toestand van materie die wordt gekenmerkt door moleculen in constante willekeurige beweging met verwaarloosbare intermoleculaire krachten1vult een willekeurige houder volledig en vertoont samendrukbaar gedrag dat wordt bepaald door druk-, volume- en temperatuurrelaties.
Vorig jaar adviseerde ik een Duitse chemisch ingenieur, Klaus Mueller, wiens reactorsysteem steeds uitviel door onverwachte drukpieken. Zijn team paste berekeningen op basis van vloeistoffen toe op gassystemen. Na het uitleggen van fundamentele gasconcepten en het implementeren van de juiste modellen voor gasgedrag, elimineerden we drukschommelingen en verhoogden we de procesefficiëntie met 42%.
Inhoudsopgave
- Wat definieert gas als een materietoestand?
- Hoe gedragen gasmoleculen zich op microscopisch niveau?
- Wat zijn de fundamentele eigenschappen van gassen?
- Hoe werken druk, volume en temperatuur op elkaar in gassen?
- Wat zijn de verschillende soorten gassen in industriële toepassingen?
- Hoe bepalen gaswetten het gedrag van industriële gassen?
- Conclusie
- Veelgestelde vragen over basisconcepten voor gas
Wat definieert gas als een materietoestand?
Gas is een van de fundamentele toestanden van materie en onderscheidt zich van vaste stoffen en vloeistoffen door unieke moleculaire ordeningen en gedragingen.
Gas wordt gedefinieerd door moleculen in voortdurende willekeurige beweging met minimale intermoleculaire aantrekkingskracht, waardoor volledige expansie mogelijk is om elke container te vullen met behoud van samendrukbare eigenschappen en een lage dichtheid in vergelijking met vloeistoffen en vaste stoffen.
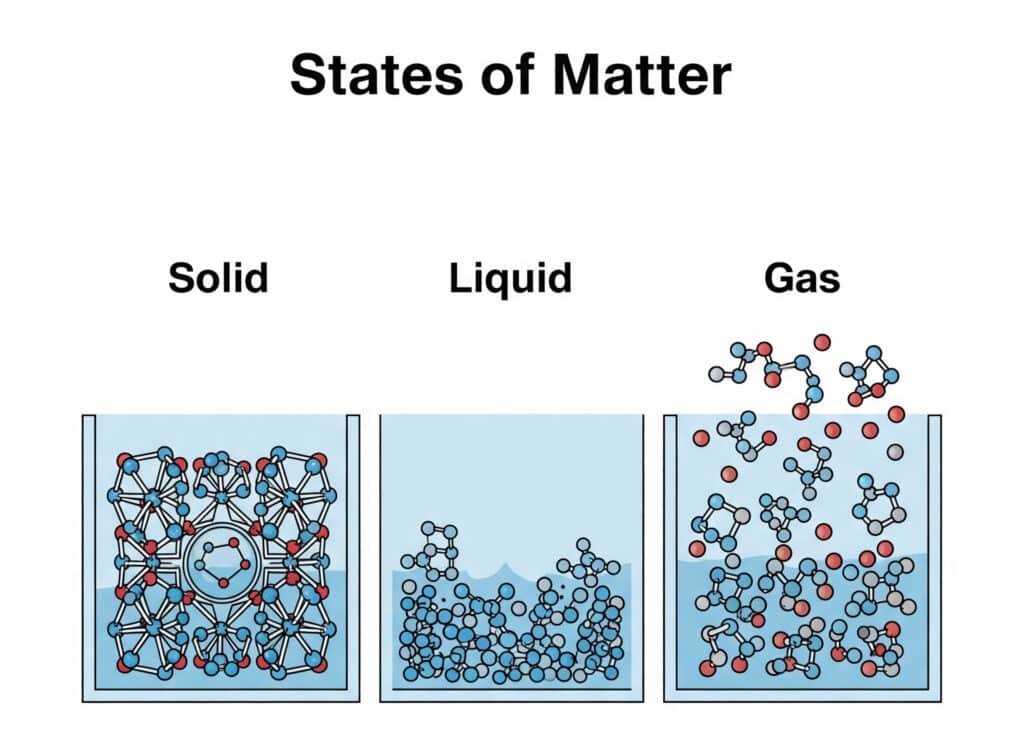
Moleculaire rangschikkingskenmerken
Gasmoleculen bestaan in een zeer ongeordende toestand met maximale bewegingsvrijheid, waardoor ze unieke fysische en chemische eigenschappen hebben.
Belangrijkste moleculaire kenmerken:
| Kenmerk | Gasstaat | Vloeibare staat | Vaste staat |
|---|---|---|---|
| Moleculaire afstand | Zeer groot (10x diameter) | Klein (1x diameter) | Vaste posities |
| Moleculaire beweging | Willekeurig, hoge snelheid | Willekeurig, beperkt | Alleen vibratie |
| Intermoleculaire krachten | Verwaarloosbaar | Matig | Sterk |
| Vorm | Geen vaste vorm | Geen vaste vorm | Vaste vorm |
| Volume | Vult container | Vast volume | Vast volume |
Samendrukbaarheidseigenschappen
In tegenstelling tot vaste stoffen en vloeistoffen vertonen gassen een aanzienlijke samendrukbaarheid door grote intermoleculaire ruimten die onder druk kunnen worden verkleind.
Vergelijking van samendrukbaarheid:
- Gassen: Zeer samendrukbaar (volume verandert aanzienlijk met de druk)
- Vloeistoffen: Licht samendrukbaar (minimale volumeverandering)
- Vaste stoffen: Bijna onsamendrukbaar (verwaarloosbare volumeverandering)
Samendrukbaarheidsfactor2: Z = PV/(nRT)
- Z ≈ 1 voor ideale gassen
- Z < 1 voor echte gassen bij hoge druk
- Z > 1 voor echte gassen bij zeer hoge druk
Dichtheidskenmerken
De gasdichtheid is aanzienlijk lager dan bij vloeistoffen of vaste stoffen door de grote intermoleculaire afstand en varieert sterk met druk en temperatuur.
Dichtheidsrelaties:
- Gasdichtheid: 0,001-0,01 g/cm³ (bij standaardomstandigheden)
- Vloeistofdichtheid: 0,5-2,0 g/cm³ (typisch bereik)
- Vaste dichtheid: 1-20 g/cm³ (typisch bereik)
Gasdichtheidsformule: ρ = PM/(RT)
Waar:
- P = druk
- M = moleculair gewicht
- R = Universele gasconstante
- T = absolute temperatuur
Uitzettings- en krimpgedrag
Gassen vertonen een dramatische uitzetting en inkrimping bij temperatuur- en drukveranderingen, volgens voorspelbare thermodynamische relaties.
Uitbreidingskenmerken:
- Thermische uitzetting: Significante volumetoename met temperatuur
- Drukreactie: Volume omgekeerd evenredig met druk
- Onbeperkte uitbreiding: Vult elke beschikbare ruimte
- Snelle stabilisatie: Bereikt snel uniforme condities
Hoe gedragen gasmoleculen zich op microscopisch niveau?
Het moleculaire gedrag van gassen volgt kinetische theorieprincipes die macroscopische gaseigenschappen verklaren door microscopische moleculaire beweging en interacties.
Gasmoleculen vertonen een willekeurige translatiebeweging met snelheden die de Maxwell-Boltzmann-verdeling volgen, waarbij ze elastische botsingen ondergaan en een gemiddelde kinetische energie behouden die evenredig is met de absolute temperatuur.
Kinetische theorie3 Grondbeginselen
De kinetische moleculaire theorie vormt de basis voor het begrijpen van het gedrag van gassen door middel van moleculaire bewegingsprincipes.
Basisaannames voor de kinetische theorie:
- Puntdeeltjes: Gasmoleculen hebben een verwaarloosbaar volume
- Willekeurige beweging: Moleculen bewegen in rechte lijnen tot botsing
- Elastische botsingen: Geen energieverlies tijdens moleculaire botsingen
- Geen intermoleculaire krachten: Behalve tijdens korte botsingen
- Temperatuurrelatie: Gemiddelde kinetische energie ∝ absolute temperatuur
Moleculaire snelheidsverdeling
Gasmoleculen vertonen een snelheidsbereik dat de Maxwell-Boltzmann-verdeling volgt, waarbij de meeste moleculen in de buurt van de gemiddelde snelheid liggen.
Parameters voor de snelheidsverdeling:
- Meest waarschijnlijke snelheid: vₘₚ = √(2RT/M)
- Gemiddelde snelheid: v̄ = √(8RT/πM)
- Gemiddelde snelheid: vᵣₘₛ = √(3RT/M)
Waar:
- R = Universele gasconstante
- T = absolute temperatuur
- M = moleculair gewicht
Temperatuureffecten op snelheid:
| Temperatuur | Gemiddelde snelheid (m/s) | Moleculaire activiteit |
|---|---|---|
| 273 K (0°C) | 461 (luchtmoleculen) | Matige beweging |
| 373 K (100°C) | 540 (luchtmoleculen) | Toegenomen beweging |
| 573 K (300°C) | 668 (luchtmoleculen) | Hoogenergetische beweging |
Botsingsfrequentie en gemiddelde vrije baan
Gasmoleculen botsen voortdurend tegen elkaar en tegen de wanden van de container en bepalen zo de druk en transporteigenschappen.
Kenmerken van botsingen:
Gemiddelde vrije baan: λ = 1/(√2 × n × σ)
Waar:
- n = aantal dichtheden van moleculen
- σ = botsingsdoorsnede
Botsingsfrequentie: ν = v̄/λ
Typische waarden onder standaardomstandigheden:
- Gemiddelde vrije baan: 68 nm (lucht bij STP)
- Botsingsfrequentie: 7 × 10⁹ botsingen/seconde
- Botsingspercentage wand: 2,7 × 10²³ botsingen/cm²-s
Energieverdeling tussen moleculen
Gasmoleculen bezitten kinetische energie die verdeeld is volgens temperatuur, waarbij hogere temperaturen een bredere energieverdeling creëren.
Energiecomponenten:
- Translationele energie: ½mv² (beweging door de ruimte)
- Rotatie-energie: ½Iω² (moleculaire rotatie)
- Trillingsenergie: Potentieel + kinetisch (moleculaire vibratie)
Gemiddelde omzettingsenergie: Eₜᵣₐₙₛ = (3/2)kT
Waarbij k = constante van Boltzmann
Wat zijn de fundamentele eigenschappen van gassen?
Gassen hebben unieke eigenschappen die hen onderscheiden van andere materietoestanden en die hun gedrag in industriële toepassingen bepalen.
Fundamentele gaseigenschappen zijn druk, volume, temperatuur, dichtheid, samendrukbaarheid, viscositeit en thermische geleidbaarheid, allemaal onderling verbonden door thermodynamische relaties en moleculair gedrag.
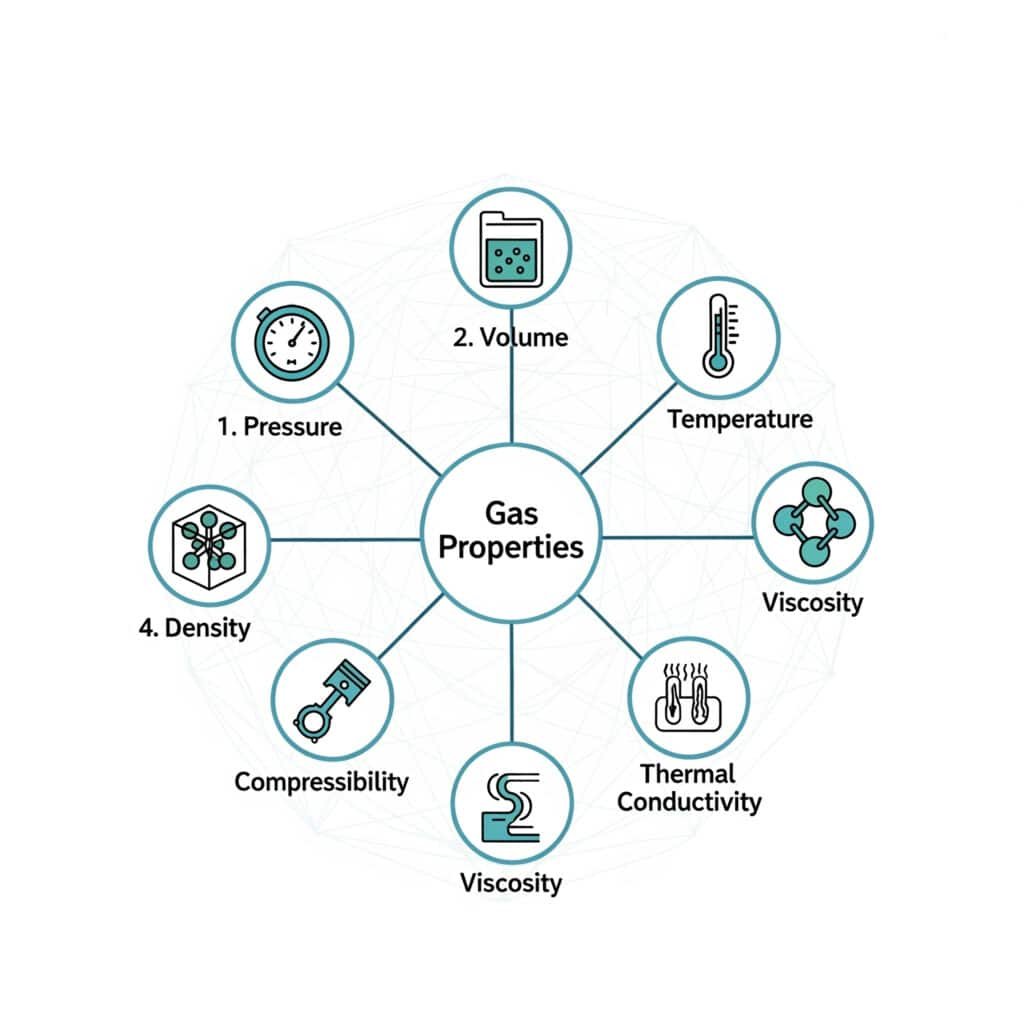
Drukeigenschappen
Gasdruk ontstaat door moleculaire botsingen met de wanden van een vat, waardoor een kracht per oppervlakte-eenheid ontstaat die varieert met de dichtheid en snelheid van de moleculen.
Drukkenmerken:
- Oorsprong: Moleculaire botsingen met oppervlakken
- Eenheden: Pascal (Pa), atmosfeer (atm), PSI
- Meting: Absolute druk vs. overdruk
- Variatie: Veranderingen met temperatuur en volume
Drukverhoudingen:
Kinetische theorie Druk: P = (1/3)nmv̄²
Waar:
- n = aantal dichtheid
- m = moleculaire massa
- v̄² = Gemiddelde kwadratische snelheid
Volume Eigenschappen
Het gasvolume vertegenwoordigt de ruimte die door moleculen wordt ingenomen, met inbegrip van zowel het moleculaire volume als de intermoleculaire ruimte.
Volume Kenmerken:
- Container Afhankelijk: Gas vult beschikbare ruimte volledig
- Samendrukbaar: Het volume verandert aanzienlijk met de druk
- Temperatuurgevoelig: Zet uit bij stijgende temperatuur
- Molair volume: Volume per mol bij standaardomstandigheden
Standaardvoorwaarden:
- STP (standaardtemperatuur en -druk): 0°C, 1 atm
- Molair volume bij STP22,4 L/mol voor ideaal gas
- SATP (Standaard omgeving): 25°C, 1 bar
Temperatuur eigenschappen
Temperatuur meet de gemiddelde moleculaire kinetische energie en bepaalt het gedrag van gassen via thermodynamische relaties.
Temperatuureffecten:
| Eigendom | Effect temperatuurstijging | Relatie |
|---|---|---|
| Moleculaire snelheid | Verhoogt | v ∝ √T |
| Druk (constante V) | Verhoogt | P ∝ T |
| Volume (constante P) | Verhoogt | V ∝ T |
| Dichtheid (constante P) | Vermindert | ρ ∝ 1/T |
Dichtheid en soortelijk volume
Gasdichtheid varieert aanzienlijk met druk en temperatuur, waardoor het een kritieke eigenschap is voor industriële berekeningen.
Dichtheidsrelaties:
Ideale gasdichtheid: ρ = PM/(RT)
Specifiek volume: v = 1/ρ = RT/(PM)
Dichtheidsvariaties:
- Drukeffect: De dichtheid neemt lineair toe met de druk
- Temperatuur: Dichtheid neemt af met de temperatuur
- Molecuulgewicht: Zwaardere gassen hebben een hogere dichtheid
- Hoogte-effect: De dichtheid neemt af met de hoogte
Viscositeitseigenschappen
Gasviscositeit bepaalt de stromingsweerstand en beïnvloedt de warmte- en massaoverdracht in industriële processen.
Viscositeitseigenschappen:
- Afhankelijkheid van temperatuur: Neemt toe met de temperatuur (in tegenstelling tot vloeistoffen)
- Druk Onafhankelijkheid: Minimaal effect bij matige druk
- Moleculaire oorsprong: Momentumoverdracht tussen gaslagen
- Maateenheden: Pa-s, cP (centipoise)
Viscositeit-temperatuurrelatie:
De formule van Sutherlandμ = μ₀(T/T₀)^(3/2) × (T₀ + S)/(T + S)
Waar S de constante van Sutherland is
Thermische geleidbaarheid
De thermische geleidbaarheid van gas bepaalt de warmteoverdracht en varieert met de temperatuur en de moleculaire eigenschappen.
Thermische geleidbaarheid Eigenschappen:
- Moleculair mechanisme: Energieoverdracht door moleculaire botsingen
- Afhankelijkheid van temperatuur: Neemt over het algemeen toe met de temperatuur
- Druk Onafhankelijkheid: Constant bij matige druk
- Afhankelijkheid van gastype: Varieert met molecuulgewicht en structuur
Hoe werken druk, volume en temperatuur op elkaar in gassen?
De interactie tussen druk, volume en temperatuur in gassen volgt fundamentele thermodynamische relaties die al het gedrag van gassen in industriële toepassingen bepalen.
Gasdruk, volume en temperatuur zijn met elkaar verbonden via de ideale gaswet4 PV = nRT, waarbij veranderingen in een eigenschap de andere beïnvloeden volgens specifieke thermodynamische processen en beperkingen.
Ideale gaswetrelaties
De ideale gaswet geeft de fundamentele relatie tussen gaseigenschappen en vormt de basis voor de meeste gasberekeningen.
Ideale gaswet Vormen:
PV = nRT (molaire vorm)
PV = mRT/M (massavorm)
P = ρRT/M (dichtheidsvorm)
Waar:
- P = absolute druk
- V = volume
- n = aantal mol
- R = Universele gasconstante (8,314 J/mol-K)
- T = absolute temperatuur
- m = massa
- M = moleculair gewicht
- ρ = dichtheid
Constante eigendomsprocessen
Het gedrag van gassen hangt af van welke eigenschappen constant blijven tijdens thermodynamische processen.
Procestypen en -relaties:
| Proces | Constante eigenschap | Relatie | Toepassing |
|---|---|---|---|
| Isotherm | Temperatuur | PV = constant | Trage compressie/uitzetting |
| Isobarisch | Druk | V/T = constant | Verwarming bij constante druk |
| Isochorisch | Volume | P/T = constant | Verwarming in harde container |
| Adiabatisch | Geen warmteoverdracht | PV^γ = constant | Snelle compressie/uitzetting |
Gecombineerde gaswet
Als de massa constant blijft maar meerdere eigenschappen veranderen, is de gecombineerde gaswet van toepassing.
Gecombineerde gaswetformule:
(P₁V₁)/T₁ = (P₂V₂)/T₂
Deze relatie is essentieel voor:
- Berekeningen gasopslag
- Ontwerp van pijpleidingen
- Dimensionering van procesapparatuur
- Ontwerp veiligheidssysteem
Echte gasafwijkingen
Echte gassen wijken onder bepaalde omstandigheden af van ideaal gedrag, waardoor correctiefactoren of alternatieve toestandsvergelijkingen nodig zijn.
Afwijkingsvoorwaarden:
- Hoge druk: Moleculair volume wordt significant
- Lage temperatuur: Intermoleculaire krachten worden belangrijk
- Dichtbij kritisch punt: Faseveranderingseffecten treden op
- Polaire moleculen: Elektrische interacties beïnvloeden het gedrag
Correctie voor samendrukbaarheidsfactor:
PV = ZnRT
Waarbij Z de samendrukbaarheidsfactor is die het echte gasgedrag weergeeft.
Onlangs hielp ik een Franse procesingenieur genaamd Marie Dubois in Lyon wiens gasopslagsysteem onverwachte drukvariaties ondervond. Door op de juiste manier rekening te houden met het echte gedrag van gas met behulp van samendrukbaarheidsfactoren, verbeterden we de nauwkeurigheid van de drukvoorspelling met 95% en namen we de veiligheidsproblemen weg.
Wat zijn de verschillende soorten gassen in industriële toepassingen?
Industriële toepassingen maken gebruik van verschillende soorten gassen, elk met unieke eigenschappen en gedragingen die hun geschiktheid voor specifieke processen en toepassingen bepalen.
Industriële gassen omvatten inerte gassen (stikstof, argon), reactieve gassen (zuurstof, waterstof), brandstofgassen (aardgas, propaan) en speciale gassen (helium, kooldioxide), die elk specifieke hantering en veiligheidsoverwegingen vereisen.
Inerte gassen
Inerte gassen zijn bestand tegen chemische reacties, waardoor ze ideaal zijn voor beschermende atmosferen en veiligheidstoepassingen.
Gebruikelijke inerte gassen:
| Gas | Chemische formule | Essentiële eigenschappen | Industrieel gebruik |
|---|---|---|---|
| Stikstof | N₂ | Niet-reactief, overvloedig | Blanketen, zuiveren, verpakken |
| Argon | Ar | Dicht, chemisch inert | Lassen, metaalbewerking |
| Helium | Hij | Licht, inert, laag kookpunt | Lektest, koeling |
| Neon | Ne | Inerte, kenmerkende gloed | Verlichting, lasers |
Toepassingen met inert gas:
- Bescherming van de atmosfeer: Voorkom oxidatie en vervuiling
- Brandbestrijding: Zuurstof verdringen om verbranding te voorkomen
- Proces Blanketing: Inerte omgeving handhaven
- Kwaliteitscontrole: Chemische reacties tijdens opslag voorkomen
Reactieve gassen
Reactieve gassen nemen deel aan chemische processen en moeten omwille van hun chemische activiteit voorzichtig gehanteerd worden.
Belangrijke reactieve gassen:
- Zuurstof (O₂): Ondersteunt verbrandings- en oxidatieprocessen
- Waterstof (H₂): Brandstofgas, reductiemiddel, hoge energiedichtheid
- Chloor (Cl₂): Chemische verwerking, waterbehandeling
- Ammoniak (NH): Kunstmestproductie, koeling
Veiligheidsoverwegingen:
- Brandbaarheid: Veel reactieve gassen zijn brandbaar of explosief
- Giftigheid: Sommige gassen zijn schadelijk of dodelijk in kleine concentraties
- Corrosiviteit: Chemische reacties kunnen apparatuur beschadigen
- Reactiviteit: Onverwachte reacties met andere materialen
Brandstofgassen
Brandstofgassen leveren energie via verbrandingsprocessen in verwarming, elektriciteitsopwekking en industriële processen.
Gemeenschappelijke brandstofgassen:
| Brandstof Gas | Verwarmingswaarde (BTU/ft³) | Vlamtemperatuur (°F) | Toepassingen |
|---|---|---|---|
| Aardgas | 1000-1100 | 3600 | Verwarming, energieopwekking |
| Propaan | 2500 | 3600 | Draagbare verwarming, snijden |
| Acetyleen | 1500 | 6300 | Lassen, snijden |
| Waterstof | 325 | 4000 | Schone brandstof, verwerking |
Speciale gassen
Speciale gassen worden gebruikt voor specifieke industriële toepassingen die een precieze samenstelling en zuiverheidsgraad vereisen.
Speciale gascategorieën:
- Ultra-hoge zuiverheid: >99,999% zuiverheid voor halfgeleiderfabricage
- Kalibratiegassen: Nauwkeurige mengsels voor instrumentkalibratie
- Medische gassen: Farmaceutische en gezondheidstoepassingen
- Onderzoek Gassen: Wetenschappelijke en laboratoriumtoepassingen
Gasmengsels
Veel industriële toepassingen maken gebruik van gasmengsels om specifieke eigenschappen of prestatiekenmerken te verkrijgen.
Veel voorkomende gasmengsels:
- Lucht: 78% N₂, 21% O₂, 1% andere gassen
- Afschermingsgas: Argon + CO₂ voor lassen
- Ademgas: Zuurstof + stikstof voor duiken
- Kalibratiegas: Nauwkeurige mengsels voor testen
Hoe bepalen gaswetten het gedrag van industriële gassen?
Gaswetten bieden het wiskundige kader voor het voorspellen en beheersen van het gasgedrag in industriële systemen, waardoor een veilig en efficiënt procesontwerp mogelijk wordt.
Gaswetten zoals de Wet van Boyle, de Wet van Charles, de Wet van Gay-Lussac en de Wet van Avogadro vormen samen de ideale gaswet, terwijl gespecialiseerde wetten zoals Wet van Dalton5 en de Wet van Graham bepalen gasmengsels en transporteigenschappen.
Toepassingen van de Wet van Boyle
De Wet van Boyle beschrijft de omgekeerde relatie tussen druk en volume bij constante temperatuur en is fundamenteel voor compressie- en expansieprocessen.
Wet van Boyle: P₁V₁ = P₂V₂ (bij constante T)
Industriële toepassingen:
- Gascompressie: Compressieverhoudingen en benodigd vermogen berekenen
- Opslagsystemen: Bepaal de opslagcapaciteit bij verschillende drukken
- Pneumatische systemen: Ontwerpen van actuatoren en besturingssystemen
- Vacuümsystemen: Bereken de pompbehoefte
Berekening van compressiewerk:
Werk = P₁V₁ ln(V₁/V₂) (isotherm proces)
Toepassingen van de Wet van Charles
De Wet van Charles regelt de verhouding tussen volume en temperatuur bij constante druk, wat cruciaal is voor berekeningen van thermische uitzetting.
Wet van Charles: V₁/T₁ = V₂/T₂ (bij constante P)
Industriële toepassingen:
- Thermische uitzetting: Houd rekening met volumeveranderingen bij temperatuur
- Warmtewisselaars: Gasvolumeveranderingen berekenen
- Veiligheidssystemen: Ontwerp voor thermische uitzettingseffecten
- Procesbeheersing: Op temperatuur gebaseerde volumecorrecties
Toepassingen van de wet van Gay-Lussac
De Wet van Gay-Lussac legt een verband tussen druk en temperatuur bij constant volume, essentieel voor het ontwerp van drukvaten en veiligheidssystemen.
Wet van Gay-Lussac: P₁/T₁ = P₂/T₂ (bij constante V)
Industriële toepassingen:
- Ontwerp van drukvaten: Bereken drukverhoging met temperatuur
- Veiligheidsontlastingssystemen: Maat overdrukventielen voor thermische effecten
- Gasopslag: Houd rekening met drukvariaties met temperatuur
- Procesveiligheid: Overdruk door verwarming voorkomen
Wet van Dalton voor partiële druk
De Wet van Dalton regelt het gedrag van gasmengsels en is essentieel voor processen met meerdere gascomponenten.
Wet van Dalton: P_totaal = P₁ + P₂ + P₃ + ... + Pₙ
Partiële drukberekening:
Pᵢ = (nᵢ/n_totaal) × P_totaal = xᵢ × P_totaal
Waarbij xᵢ de molfractie is van component i
Toepassingen:
- Gasscheiding: Scheidingsprocessen ontwerpen
- Verbrandingsanalyse: Lucht-brandstofverhoudingen berekenen
- Milieubewaking: Gasconcentraties analyseren
- Kwaliteitscontrole: Gaszuiverheid controleren
Grahams Effusie Wet
De Wet van Graham beschrijft de snelheid van gasdiffusie en -uitstoot op basis van verschillen in moleculair gewicht.
Wet van Graham: r₁/r₂ = √(M₂/M₁)
Waarbij r de uitvloeiingssnelheid is en M het molecuulgewicht
Industriële toepassingen:
- Gasscheiding: Ontwerp membraanscheidingssystemen
- Lekdetectie: Gasontsnappingssnelheden voorspellen
- Mengprocessen: Mengtijden berekenen
- Massaoverdracht: Ontwerp gasabsorptiesystemen
Toepassingen van de Wet van Avogadro
De Wet van Avogadro relateert het volume aan de hoeveelheid gas bij constante temperatuur en druk.
Wet van Avogadro: V₁/n₁ = V₂/n₂ (bij constante T en P)
Toepassingen:
- Stoichiometrische berekeningen: Chemische reactie volumes
- Gasmeting: Debietmetingen
- Procesontwerp: Reactor dimensioneringsberekeningen
- Kwaliteitscontrole: Concentratiemetingen
Onlangs werkte ik met een Italiaanse chemisch ingenieur genaamd Giuseppe Romano in Milaan wiens gasmengsysteem inconsistente resultaten opleverde. Door de Wet van Dalton en de juiste partiële drukberekeningen toe te passen, bereikten we een mengnauwkeurigheid van ±0,1% en elimineerden we problemen met de productkwaliteit.
Conclusie
Gas is een fundamentele toestand van materie die wordt gekenmerkt door moleculaire beweging, samendrukbaar gedrag en druk-volume-temperatuurrelaties die worden beheerst door thermodynamische wetten die industriële gastoepassingen en veiligheidsvereisten bepalen.
Veelgestelde vragen over basisconcepten voor gas
Wat is de basisdefinitie van gas?
Gas is een materietoestand waarin moleculen in een constante willekeurige beweging zijn met verwaarloosbare intermoleculaire krachten. Het vult elke houder volledig en vertoont samendrukbaar gedrag dat wordt bepaald door druk-, volume- en temperatuurrelaties.
Hoe bewegen en gedragen gasmoleculen zich?
Gasmoleculen bewegen willekeurig in rechte lijnen tot botsingen optreden, waarbij de snelheden de Maxwell-Boltzmann-verdeling volgen en de gemiddelde kinetische energie evenredig is met de absolute temperatuur volgens de kinetische moleculaire theorie.
Waarin verschillen gassen van vloeistoffen en vaste stoffen?
Gassen hebben een veel grotere intermoleculaire afstand, verwaarloosbare intermoleculaire krachten, hoge samendrukbaarheid, lage dichtheid en het vermogen om elke houder volledig te vullen, in tegenstelling tot de vaste ordening in vaste stoffen en vloeistoffen.
Wat is de ideale gaswet en waarom is die belangrijk?
De ideale gaswet (PV = nRT) legt een verband tussen druk, volume, temperatuur en hoeveelheid gas en vormt de fundamentele vergelijking voor gasberekeningen in industriële toepassingen en procesontwerp.
Hoe beïnvloeden druk, volume en temperatuur elkaar in gassen?
Gasdruk, volume en temperatuur zijn onderling verbonden door thermodynamische relaties waarbij veranderingen in de ene eigenschap de andere beïnvloeden volgens specifieke procesbeperkingen (isothermisch, isobarisch, isochorisch of adiabatisch).
Wat zijn de belangrijkste soorten industriële gassen?
Industriële gassen omvatten inerte gassen (stikstof, argon), reactieve gassen (zuurstof, waterstof), brandstofgassen (aardgas, propaan) en speciale gassen (helium, CO₂), elk met specifieke eigenschappen en veiligheidsvereisten.
-
Geeft een gedetailleerde uitleg van intermoleculaire krachten (zoals van der Waals krachten en waterstofbruggen), de aantrekkingen of afstotingen tussen naburige moleculen die de fysische eigenschappen en de toestand van een stof bepalen. ↩
-
Legt het concept van de samendrukbaarheidsfactor (Z) uit, een correctiefactor die in de thermodynamica wordt gebruikt om rekening te houden met de afwijking van een echt gas van ideaal gasgedrag, wat cruciaal is voor nauwkeurige berekeningen bij hoge druk of lage temperaturen. ↩
-
Biedt een overzicht van de kinetische theorie van gassen, een wetenschappelijk model dat de macroscopische eigenschappen van gassen (zoals druk en temperatuur) verklaart door rekening te houden met de willekeurige beweging en botsingen van de samenstellende moleculen. ↩
-
Beschrijft de ideale gaswet (PV=nRT), de fundamentele toestandsvergelijking die het gedrag van de meeste gassen onder verschillende omstandigheden benadert door hun druk, volume, temperatuur en hoeveelheid met elkaar in verband te brengen. ↩
-
Gaat in op de Wet van Dalton, die stelt dat in een mengsel van niet-reagerende gassen de totale uitgeoefende druk gelijk is aan de som van de partiële drukken van de afzonderlijke gassen, een fundamenteel principe voor het omgaan met gasmengsels. ↩


